题目内容
14.下列叙述错误的是( )| A. | 把a L 0.1 mol•L-1的CH3COOH溶液与b L 0.1 mol•L-1的KOH溶液混合,所得溶液中一定存在:c(K+)+c(H+)=c(CH3COO-)+c(OH-) | |
| B. | 把0.1 mol•L-1的CH3COOH溶液与0.3 mol•L-1的Ba(OH)2溶液等体积混合,所得溶液中一定存在:c(OH-)>c(Ba2+)>c(CH3COOH)>c(H+) | |
| C. | 向1 mol•L-1的CH3COOH溶液中加入少量CH3COONa固体,由于CH3COONa水解显碱性,所以溶液的pH升高 | |
| D. | 常温下,在pH=3的CH3COOH溶液和pH=11的NaOH溶液中,水的电离程度相同 |
分析 A.溶液中一定满足电荷守恒,根据混合液中的电荷守恒判断;
B.反应后溶质为0.025mol/L的醋酸钡、0.125mol/L的氢氧化钡,则氢氧根离子浓度为0.25mol/L,钡离子浓度为0.15mol/L,醋酸根离子部分水解生成醋酸,溶液呈强碱性,则氢离子浓度最小;
C.加入醋酸钠固体后,由于醋酸根离子浓度增大,抑制了醋酸的电离程度,导致溶液中氢离子浓度减小,则溶液pH升高;
D.醋酸和氢氧化钠溶液都抑制了水的电离,醋酸溶液中的氢氧根离子、氢氧化钠溶液中的氢离子是水的电离的,据此进行计算.
解答 解:A.把a L0.1 mol•L-1的CH3COOH溶液与b L0.1mol•L-1的KOH溶液混合,无论如何反应,所得溶液中一定满足电荷守恒:c(K+)+c(H+)=c(CH3COO-)+c(OH-),故A正确;
B.把0.1 mol•L-1的CH3COOH溶液与0.3 mol•L-1的Ba(OH)2溶液等体积混合,溶质为0.025mol/L的醋酸钡、0.125mol/L的氢氧化钡,则c(OH-)=为0.25mol/L,c(Ba2+)=0.15mol/L,醋酸根离子部分水解生成CH3COOH,由于溶液呈强碱性,则c(H+)最小,溶液中离子浓度大小为:所得溶液中一定存在:c(OH-)>c(Ba2+)>c(CH3COOH)>c(H+),故B正确;
C.加入少量的CH3COONa固体后,溶液中c(CH3COO-)增大,醋酸的电离平衡CH3COOH?CH3COO-+H+向左移动,溶液中的c(H+)减小,c(OH-)增大,导致溶液的pH升高,故C错误;
D.常温下,在pH=3的CH3COOH溶液中,醋酸电离出的氢离子抑制了水的电离,溶液中氢氧根离子水电离的,则水电离的氢离子浓度为:c(H+)=$\frac{1{0}^{-14}}{1{0}^{-3}}$mol/L=1×10-11mol/L;pH=11的NaOH溶液中,氢氧根离子抑制了水的电离,溶液中氢离子是水电离的,则水电离的氢离子浓度为:c(H+)=1×10-11mol/L,所以两溶液中水的电离程度相同,故D正确;
故选C.
点评 本题考查了酸碱混合的定性判断及溶液pH的计算、离子浓度大小比较,题目难度中等,明确反应后溶质组成为解答关键,注意掌握盐的水解原理、电荷守恒的含义及溶液酸碱性与溶液pH的关系,试题培养了学生的分析、理解能力及灵活应用能力.

 智慧小复习系列答案
智慧小复习系列答案| A. | F | B. | N | C. | Zn | D. | Al |
| A. | CH3CH3+Br2→CH3CH2Br+HBr | |
| B. | 2CH3CHO+O2 $→_{△}^{催化剂}$ 2CH3COOH | |
| C. | CH3CH=CH2+Br2→CH3CHBr-CH2Br | |
| D. | 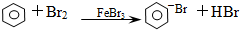 |
| A. | 1:1 | B. | 2:1 | C. | 1:2 | D. | 4:1 |
| X | ||
| Y | Z |
(1)Z的单质与NaOH 溶液反应的化学方程式2Al+2H2O+2NaOH=3H2↑+2NaAlO2
(2)X与浓硫酸反应的化学方程式:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O.
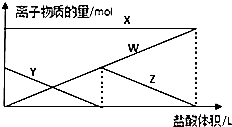 向aL1mol•L-1的Na2CO3的溶液中缓慢地滴加bL1mol•L-1的盐酸,并不断搅拌,随着盐酸的加入,溶液中离子物质的量也相应地发生变化如图所示(不考虑盐类的水解及水的电离),下列说法正确的是( )
向aL1mol•L-1的Na2CO3的溶液中缓慢地滴加bL1mol•L-1的盐酸,并不断搅拌,随着盐酸的加入,溶液中离子物质的量也相应地发生变化如图所示(不考虑盐类的水解及水的电离),下列说法正确的是( )| A. | 四条线与溶液中离子的对应关系是:X:Na+;Y:CO32-;Z:Cl-;W:HCO3- | |
| B. | 当a<b<2a时,发生的离子方程式为:CO32-+H+=CO2↑+H2O | |
| C. | 当3b=2a时,发生的离子方程式为:HCO3-+H+=CO2↑+H2O | |
| D. | 当$\frac{a}{2}$<b<a时,溶液中HCO32-与CO32-的物质的量之比为b:(a-b) |
| A. | 一定条件下,当N2的生成速率与N2的分解速率相等时,该反应处于平衡状态 | |
| B. | 取1mol N2和3mol H2放在密闭容器内反应达平衡时,生成2 mol NH3 | |
| C. | 一定条件下反应达到平衡,再充入N2,则正反应速率增大,逆反应速率减小 | |
| D. | 一定条件下反应达到平衡,若升高温度,反应速率增大,平衡向正反应方向移动 |
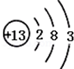 根据如图的原子结构示意图回答下列问题.
根据如图的原子结构示意图回答下列问题.