题目内容
6.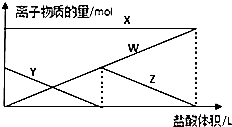 向aL1mol•L-1的Na2CO3的溶液中缓慢地滴加bL1mol•L-1的盐酸,并不断搅拌,随着盐酸的加入,溶液中离子物质的量也相应地发生变化如图所示(不考虑盐类的水解及水的电离),下列说法正确的是( )
向aL1mol•L-1的Na2CO3的溶液中缓慢地滴加bL1mol•L-1的盐酸,并不断搅拌,随着盐酸的加入,溶液中离子物质的量也相应地发生变化如图所示(不考虑盐类的水解及水的电离),下列说法正确的是( )| A. | 四条线与溶液中离子的对应关系是:X:Na+;Y:CO32-;Z:Cl-;W:HCO3- | |
| B. | 当a<b<2a时,发生的离子方程式为:CO32-+H+=CO2↑+H2O | |
| C. | 当3b=2a时,发生的离子方程式为:HCO3-+H+=CO2↑+H2O | |
| D. | 当$\frac{a}{2}$<b<a时,溶液中HCO32-与CO32-的物质的量之比为b:(a-b) |
分析 根据向一定量的Na2CO3溶液中缓慢地滴加稀盐酸,则先后发生Na2CO3+HCl═NaCl+NaHCO3、NaHCO3+HCl═NaCl+CO2↑+H2O,则钠离子数目不发生变化,氯离子的数目在增加,碳酸根离子的数目一直在减少,直到为0,碳酸氢根离子的数目先增大后减小,直到为0,然后结合图象和离子方程式分析判断.
解答 解:A.因向一定量的Na2CO3溶液中缓慢地滴加稀盐酸,则先后发生Na2CO3+HCl═NaCl+NaHCO3、NaHCO3+HCl═NaCl+CO2↑+H2O,
则钠离子的数目不变,即图中X为Na+离子,碳酸根离子在减少,直至为0,即图中Y为CO32-离子,碳酸氢根离子先增大后减小,直至为0,即图中Z为HCO3-离子,
氯离子先为0,随盐酸的加入氯离子的数目在增多,即图中W为Cl-离子,故A错误;
B.当a<b<2a时,发生的离子方程式为:CO32-+H+=HCO3-,HCO3-+H+=CO2↑+H2O,故B错误;
C.当3b=2a时,没有气体生成,发生的离子方程式为:CO32-+H+=HCO3-,故C错误;
D.当$\frac{a}{2}$<b<a时,只发生CO32-+H+=HCO3-,bmolHCl生成bmolHCO3-,溶液中剩余的CO32-为a-bmol,则溶液中HCO32-与CO32-的物质的量之比为b:(a-b),故D正确.
故选D.
点评 本题以碳酸钠与盐酸的反应来分析溶液中离子的变化,明确离子反应的实质并学会结合图象来判断离子数目是解答的关键,题目难度中等,侧重于考查学生的分析能力和计算能力.

练习册系列答案
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案
相关题目
16.已知:(1)Zn(s)+$\frac{1}{2}$O2(g)═ZnO(s),△H=-348.3kJ•mol-1,
(2)2Ag(s)+$\frac{1}{2}$O2(g)═Ag2O(s),△H=-31.0kJ•mol-1,
则Zn(s)+Ag2O(s)═ZnO(s)+2Ag(s)的△H等于( )
(2)2Ag(s)+$\frac{1}{2}$O2(g)═Ag2O(s),△H=-31.0kJ•mol-1,
则Zn(s)+Ag2O(s)═ZnO(s)+2Ag(s)的△H等于( )
| A. | -379.3 kJ•mol-1 | B. | -317.3 kJ•mol-1 | C. | -332.8 kJ•mol-1 | D. | 317.3 kJ•mol-1 |
14.下列叙述错误的是( )
| A. | 把a L 0.1 mol•L-1的CH3COOH溶液与b L 0.1 mol•L-1的KOH溶液混合,所得溶液中一定存在:c(K+)+c(H+)=c(CH3COO-)+c(OH-) | |
| B. | 把0.1 mol•L-1的CH3COOH溶液与0.3 mol•L-1的Ba(OH)2溶液等体积混合,所得溶液中一定存在:c(OH-)>c(Ba2+)>c(CH3COOH)>c(H+) | |
| C. | 向1 mol•L-1的CH3COOH溶液中加入少量CH3COONa固体,由于CH3COONa水解显碱性,所以溶液的pH升高 | |
| D. | 常温下,在pH=3的CH3COOH溶液和pH=11的NaOH溶液中,水的电离程度相同 |
1.下列物质既能与盐酸反应,又能与氢氧化钠溶液反应的是( )
①Ba(OH)2 ②Al ③NaHCO3 ④Al2O3 ⑤NaHSO4 ⑥氨基酸 ⑦NH4HS.
①Ba(OH)2 ②Al ③NaHCO3 ④Al2O3 ⑤NaHSO4 ⑥氨基酸 ⑦NH4HS.
| A. | ②④⑥ | B. | ②③⑤⑥ | C. | ①③④⑥ | D. | ②③④⑥⑦ |
11.某烃相对分子质量为82,试判断它可能是( )
| A. | 环烷烃 | B. | 芳香烃 | ||
| C. | 含有5个碳原子的烃 | D. | 二烯烃 |
18.要验证Mg、Fe、Zn三种金属的活动性顺序,可选用下列哪组物质进行实验( )
| A. | Zn、FeCl2溶液、MgCl2溶液 | B. | Fe、Zn、MgCl2溶液 | ||
| C. | Mg、ZnCl2、FeSO4溶液 | D. | Fe、ZnSO4溶液、MgCl2溶液 |
16.在下列溶液中一定能大量共存的离子组是( )
| A. | pH=2的溶液:Fe2+、NH4+、Cl-、NO3- | |
| B. | 能使pH试纸变深蓝色的溶液:Na+、NO3-、S2-、CO32- | |
| C. | 含有大量Fe3+的溶液:SCN-、I-、K+、Br- | |
| D. | 澄清透明的无色溶液:ClO-、MnO4-、Al3+、S2- |
17.下列叙述正确的是( )
| A. | 目前加碘食盐中主要添加的是KIO3 | |
| B. | 注射用的生理盐水的浓度为0.09% | |
| C. | 绿色食品是不含任何化学物质的食品 | |
| D. | 在空气质量日报中CO2含量属于空气污染指数 |
