题目内容
8.把a、b、c、d四种金属片浸泡在电解质溶液中,用导线两两相连可以组成各种原电池.若a、b相连时,a为负极;c、d相连时,c不断溶解;a、c相连时,c产生气泡;b、d相连时,b增重,则这四种金属活动性顺序由大到小为( )| A. | a>b>c>d | B. | a>c>d>b | C. | c>a>b>d | D. | b>d>c>a |
分析 形成原电池时,活泼金属做负极,根据电极反应现象首先判断电池的正负极,再判断金属的活泼性强弱.
解答 解:形成原电池时,活泼金属做负极,若a、b相连时,a为负极,则金属活动性a>b,c、d相连时,c不断溶解,则c为负极,活动性c>d,a、c相连时,c极上产生大量气泡,说明在c极上产生氢气,c极上发生还原反应,c极为正极,则活动性a>c,b、d相连时,b增重,金属阳离子得电子,b极上发生还原反应,b极为正极,则活动性d>b,所以四种金属的活动性顺序为a>c>d>b,
故选B.
点评 本题从原电池的角度比较金属性的活动性顺序,正确判断原电池负极是解本题关键,难度不大.

练习册系列答案
相关题目
1.列有关化学用语表达正确的是( )
| A. | 氨气分子的电子式: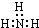 | B. | S2-的结构示意图: | ||
| C. | CH4的球棍模型示意图为: | D. | 用电子式表示HCl形成过程: |
19.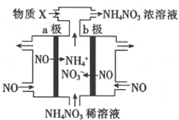 电解NO制备NH4NO3的工作原理如图所示,为使电解产物全部转化为NH4NO3,通入物质X.下列说法不正确的是( )
电解NO制备NH4NO3的工作原理如图所示,为使电解产物全部转化为NH4NO3,通入物质X.下列说法不正确的是( )
 电解NO制备NH4NO3的工作原理如图所示,为使电解产物全部转化为NH4NO3,通入物质X.下列说法不正确的是( )
电解NO制备NH4NO3的工作原理如图所示,为使电解产物全部转化为NH4NO3,通入物质X.下列说法不正确的是( )| A. | a极接电源的负极 | |
| B. | 阳极反应为:NO-3e-+2H2O=NO3-+4H+ | |
| C. | 阴极反应为:NO+5e-+6H+=NH4++H2O | |
| D. | X为NH3最终制得3molNH4NO3理论上需补充2molX物质 |
16.下列有关实验操作、现象和结论都正确的是( )
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向溶液中滴加BaCl2溶液,再加入盐酸 | 产生白色沉淀不溶解 | 原溶液中有SO42- |
| B | 将黄豆粒大的钠放入CuSO4稀溶液中 | 产生红色固体 | 金属性:Na>Cu |
| C | 向1mL20%的蔗糖溶液中加入几滴稀硫酸,水浴加热后取少量NaOH溶液,再加入新制的Cu(OH)2,加热 | 产生砖红色沉淀 | 蔗糖水解产生葡萄糖 |
| D | 向盛有少量Na2O2固体的试管中加入一定量的蒸馏水,再滴加酚酞试液 | 溶液变红后褪色 | 说明可能生成了H2O2 |
| A. | A | B. | B | C. | C | D. | D |
13.化学与社会、生活和生产息息相关,以下叙述不正确的是( )
| A. | 氢气的燃烧产物是水,是理想的清洁燃料,未来可以利用蓝绿藻和微生物制备氢气 | |
| B. | 生物炼铜的原理是利用某些具有特殊本领的细菌把不溶性的硫化铜转化为硫酸铜 | |
| C. | 使用太阳能热水器、沼气的利用、玉米制乙醇都涉及到生物质能的利用 | |
| D. | 硅晶体的导电性介于导体与绝缘体之间,是一种重要的半导体材料,广泛应用于制造集成电路、太阳能电池板等 |
20.根据热化学方程式:S(g)+O2(g)=SO2(g)△H=-Q kJ•mol-1,下列分析正确的是( )
| A. | 1 mol S(g)与1 mol O2(g) 的总能量比1 mol SO2(g)的总能量低QkJ | |
| B. | 1mol S(g) 与1 mol O2(g) 反应生成1 mol SO2(g)放出Q kJ的热量 | |
| C. | S(s)+O2(g)=SO2(g)△H<-Q kJ•mol-1 | |
| D. | 1个S(g)与1个O2(g) 完全反应可以放出Q kJ的热量 |
17.标准状况下,在干燥的烧瓶中充满纯净的NH3进行如图所示的喷泉实验下列说法错误的是( )
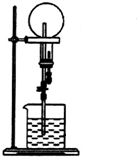

| A. | 若烧瓶的氨气中混有少量氮气,则喷泉实验后的水不能充满烧瓶 | |
| B. | 本实验之所以能够产生喷泉是因为氨气极易溶于水,导致烧瓶内外存在压强差 | |
| C. | 本实验若将NH3换成Cl2,烧杯中水换成饱和食盐水,也能产生喷泉 | |
| D. | 实验结束后烧瓶中氨水的物质的量浓度为$\frac{1}{22.4}$ mol•L-1 |
18.在一定温度下的某容积可变的密闭容器中进行反应:C(s)+H2O(g)?CO(g)+H2(g).下列说法或结论不成立的是( )
| A. | 当体系的体积不再发生变化,该反应已建立平衡 | |
| B. | 达到平衡后向体系中充入少量He,平衡不移动 | |
| C. | 增大水蒸气的用量可以提高碳粉的转化率 | |
| D. | 若断裂1 molH-H键的同时断裂2molH-O键,则反应达到平衡 |
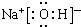 .
.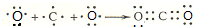
 .
.