题目内容
19.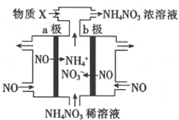 电解NO制备NH4NO3的工作原理如图所示,为使电解产物全部转化为NH4NO3,通入物质X.下列说法不正确的是( )
电解NO制备NH4NO3的工作原理如图所示,为使电解产物全部转化为NH4NO3,通入物质X.下列说法不正确的是( )| A. | a极接电源的负极 | |
| B. | 阳极反应为:NO-3e-+2H2O=NO3-+4H+ | |
| C. | 阴极反应为:NO+5e-+6H+=NH4++H2O | |
| D. | X为NH3最终制得3molNH4NO3理论上需补充2molX物质 |
分析 电解NO制备NH4NO3,b为阳极反应为NO-3e-+2H2O=NO3-+4H+,a为阴极反应为:NO+5e-+6H+=NH4++H2O,从两极反应可看出,要使得失电子守恒,阳极产生的NO3-的物质的量大于阴极产生的NH4+的物质的量,总反应方程式为:8NO+7H2O$\frac{\underline{\;电解\;}}{\;}$3NH4NO3+2HNO3,因此若要使电解产物全部转化为NH4NO3,需补充NH3,据此分析.
解答 解:电解NO制备NH4NO3,b为阳极反应为NO-3e-+2H2O=NO3-+4H+,a为阴极反应为:NO+5e-+6H+=NH4++H2O,从两极反应可看出,要使得失电子守恒,阳极产生的NO3-的物质的量大于阴极产生的NH4+的物质的量,总反应方程式为:8NO+7H2O$\frac{\underline{\;电解\;}}{\;}$3NH4NO3+2HNO3,因此若要使电解产物全部转化为NH4NO3,需补充NH3.
A.a为阴极反应为:NO+5e-+6H+=NH4++H2O,a极接电源的负极,故A正确;
B.b为阳极反应为:NO-3e-+2H2O=NO3-+4H+,故B正确;
C.a为阴极反应为:NO+5e-+6H+=NH4++H2O,故C正确;
D.根据以上分析,则X为NH3,最终制得3molNH4NO3,设需补充xmolNH3,根据总反应方程式为:8NO+7H2O$\frac{\underline{\;电解\;}}{\;}$3NH4NO3+2HNO3,则NH3~HNO3~$\frac{3}{2}$NH4NO3则x+$\frac{3x}{2}$=3,x=1.2,理论上需补充NH31.2mol,故D错误;
故选D.
点评 本题考查了电解原理的应用等,题目涉及的知识点较多,侧重于考查学生的综合运用能力,难度中等,注意基础知识的积累掌握.

| A. | 能使酸性KMnO4溶液褪色,说明SO2具有漂白性 | |
| B. | 能使澄清石灰水变浑浊 | |
| C. | 不能与NaOH溶液反应 | |
| D. | 能与水反应生成硫酸 |
| 混合物 | 分离方法 | 操作过程 | |
| 1 | 从草木灰中提取可溶性物质 | 溶解、过滤 | 将草木灰溶于热水中,不断搅拌, 然后过滤.若滤液仍浑浊,再过滤 |
| 2 | KNO3和NaCl混合物 | 结晶、过滤 | 将混合物溶于热水配成饱和溶液降温,溶液中有KNO3晶体析出,冷却过滤 |
| 3 | 由乙醇溶液制无水乙醇 | 蒸馏 | 加入一定量的生石灰,然后蒸馏 |
| 4 | 除去淀粉溶液中的碘化钠 | 渗析 | 将混合液放入半透膜袋中,并放入流动的蒸馏水中 |
| A. | 纤维素水解的产物可以制乙醇 | |
| B. | 乙烯、聚乙烯、聚氯乙烯都属于烃,都可以使溴水褪色 | |
| C. | “歼-20”飞机上使用的碳纤维是一种新型的有机高分子材料 | |
| D. | NH4NO3、KNO3、KClO3与Na2S、C2H5OH混合搭存放在同一仓库 |
| A. | a>b>c>d | B. | a>c>d>b | C. | c>a>b>d | D. | b>d>c>a |
| X | Y | ||
| Z | W | Q |
| A. | 钠与W可以形成离子化合物Na2W2 | |
| B. | 由Z与Y组成的物质在熔融时能导电 | |
| C. | 氧化物对应水化物的酸性:Q>W | |
| D. | 固态XY2和ZY2的化学键类型、晶体类型都相同 |
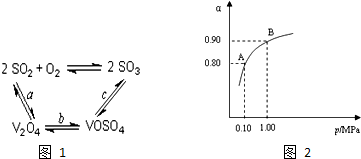 工业上以黄铁矿为原料生产硫酸主要分为三个阶段进行,即煅烧、催化氧化、吸收.请回答下列问题:
工业上以黄铁矿为原料生产硫酸主要分为三个阶段进行,即煅烧、催化氧化、吸收.请回答下列问题:
 元素周期表的排列和分区与元素基态原子核外电子的排布息息相关,请据此回答下列问题:
元素周期表的排列和分区与元素基态原子核外电子的排布息息相关,请据此回答下列问题: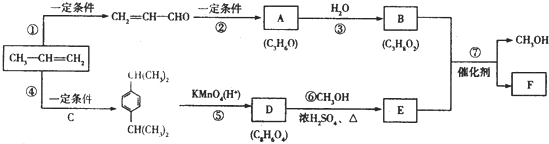
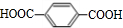 ;F的结构简式为
;F的结构简式为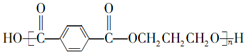 .
.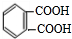 .
.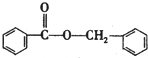 )的合成路线
)的合成路线 .
.