题目内容
2.为提纯下列物质(括号内为杂质),选用的试剂和分离方法都正确的是( )| 物质 | 试剂 | 分离方法 | |
| ① | 硝酸钾(氯化钠) | 蒸馏水 | 降温结晶 |
| ② | Na2SO4(NH4Cl) | 加入升华 | |
| ③ | 乙醇(水) | 金属钠 | 蒸馏 |
| ④ | NaCl溶液(Na2S) | AgCl | 过滤 |
| A. | ①③ | B. | ①④ | C. | 只有② | D. | ③④ |
分析 ①二者溶解度受温度影响不同;
②氯化铵加热分解生成气体;
③二者均与Na反应;
④AgCl与Na2S发生沉淀的转化反应.
解答 解:①二者溶解度受温度影响不同,则利于水溶解后,降温结晶可分离,故正确;
②氯化铵加热分解生成气体,硫酸钠不反应,加热法可分离,不是升华法,故错误;
③二者均与Na反应,不能除杂,应选CaO、蒸馏,故错误;
④AgCl与Na2S发生沉淀的转化反应生成沉淀和NaCl,反应后过滤可除杂,故正确;
故选B.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、性质差异及发生的反应为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.

练习册系列答案
 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案
相关题目
12.反应A(g)+3B(g)═2C(g)+2D(g),在不同情况下测得反应速率,其中反应速率最快的是( )
| A. | v(A)=0.4mol/(L•s) | B. | v(B)=0.5mol/(L•s) | C. | v(C)=0.6mol/(L•s) | D. | v(D)=0.7mol/(L•s) |
13.X、Y是周期表中的两种元素,X原子的半径比Y的半径小,且具有相同的电子层数,(选项中m、n均为正整数)下列有关叙述正确的是( )
| A. | 若X、Y原子序数相差l,Y为IIA族,则X一定是IIIA族 | |
| B. | 若Y(OH)m易溶于水,则X(OH)n一定不溶于水 | |
| C. | 若HnXOm为强酸,则X的氢化物溶液于水一定显酸性 | |
| D. | 若Y元素形成的单质是气体,则X元素形成的单质一定也是气体 |
10.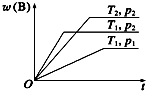 可逆反应:aA(g)+bB(g)?cC(g)在不同温度(T1和T2)及压强(p1和p2)下混合气体中B的质量分数w(B)与反应时间(t)的关系如图所示.下列判断正确的是( )
可逆反应:aA(g)+bB(g)?cC(g)在不同温度(T1和T2)及压强(p1和p2)下混合气体中B的质量分数w(B)与反应时间(t)的关系如图所示.下列判断正确的是( )
 可逆反应:aA(g)+bB(g)?cC(g)在不同温度(T1和T2)及压强(p1和p2)下混合气体中B的质量分数w(B)与反应时间(t)的关系如图所示.下列判断正确的是( )
可逆反应:aA(g)+bB(g)?cC(g)在不同温度(T1和T2)及压强(p1和p2)下混合气体中B的质量分数w(B)与反应时间(t)的关系如图所示.下列判断正确的是( )| A. | a+b<c,正反应为放热反应 | B. | a+b<c,正反应为吸热反应 | ||
| C. | a+b>c,正反应为吸热反应 | D. | a+b>c,正反应为放热反应 |
17.下列各组离子中,能在强酸性溶液中能大量共存的是( )
| A. | Na+、K+、Ca2+、HCO3- | B. | OH-、Cl-、Na+、NH${\;}_{4}^{+}$ | ||
| C. | Cu2+、Na+、SO42-、Cl- | D. | Mg2+、Na+、Cl-、CH3COO- |
2.关于NH4Cl(s)?NH3(g)+HCl(g)的平衡常数书写形式,正确的是( )
| A. | K=$\frac{[N{H}_{3}][HCl]}{[N{H}_{4}Cl]}$ | B. | K=$\frac{[N{H}_{4}Cl]}{[N{H}_{3}][HCl]}$ | C. | K=[NH3][HCl] | D. | K=$\frac{[N{H}_{3}]}{[N{H}_{4}Cl]}$ |
9.设NA为阿伏加德罗常数值.下列有关叙述正确的是( )
| A. | 14 g乙烯和丙烯混合气体中的氢原子数为2NA | |
| B. | 1 molN2与4 mol H2反应生成的NH3分子数为2NA | |
| C. | 1 molFe溶于过量硝酸,电子转移数为2NA | |
| D. | 标准状况下,2.24 LCCl4含有的共价键数为0.4NA |
7.反应A(g)+3B(g)?2C(g)在2L密闭容器中反应,0.5min内C的物质的量增加了0.6mol有关反应速率中正确的是( )
| A. | v(A)=0.005mol•L-1•s-1 | B. | v(C)=0.02mol•L-1•s-1 | ||
| C. | v(B)=$\frac{v(A)}{3}$ | D. | v(A)=0.01mol•L-1•s-1 |
