题目内容
10.下列反应可以设计成原电池的是( )①CaO+H2O═Ca(OH)2
②Fe+H2SO4═FeSO4+H2↑
③2H2O═2H2↑+O2↑
④NaCl+AgNO3═AgCl↓+NaNO3
⑤Cu+2AgNO3═2Ag+Cu(NO3)2
⑥Fe+2FeCl3═3FeCl2.
| A. | ①②④⑤⑥ | B. | ②③⑤⑥ | C. | ②⑤⑥ | D. | 全部 |
分析 根据原电池的形成条件中“能自发的发生氧化还原反应”判断.
解答 解:①CaO+H2O═Ca(OH)2,反应前后各元素的化合价不变,所以不是发生氧化还原反应,不能设计成原电池;
②Fe+H2SO4═FeSO4+H2↑,反应前后有元素化合价的变化,所以能设计成原电池;
③2H2O═2H2↑+O2↑,反应前后有元素化合价的变化,但该反应不是自发的进行的氧化还原反应,所以不能设计成原电池;
④NaCl+AgNO3═AgCl↓+NaNO3,反应前后各元素的化合价不变,所以不是发生氧化还原反应,不能设计成原电池;
⑤Cu+2AgNO3═2Ag+Cu(NO3)2,反应前后有元素化合价的变化,且该反应是自发进行的氧化还原反应,所以能设计成原电池;
⑥Fe+2FeCl3═3FeCl2,反应前后有元素化合价的变化,且该反应是自发进行的氧化还原反应,所以能设计成原电池.
故选:C.
点评 本题是考查原电池的设计,难度不大,明确原电池的构成条件是解本题的关键.

练习册系列答案
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
20.把X、Y、Z三种金属分别浸入相同质量分数的稀硫酸中,Y表面有气泡产生,X、Z表面无明显变化;把Z金属浸入X的硝酸盐溶液中,Z表面析出X.则三种金属的活动性顺序由强到弱的是( )
| A. | Y、Z、X | B. | X、Y、Z | C. | X、Z、Y | D. | Z、Y、X |
1.化学知识在生产、生活中有着广泛的应用.下列说法中正确的是( )
| A. | 单质硅是将太阳能转变为电能的常用材料 | |
| B. | 制作航天服的聚酯纤维是新型无机非金属材料 | |
| C. | 为了防止食品受潮变质,常在食品包装袋中放入活性铁粉 | |
| D. | 碱性锌锰干电池属于二次电池 |
18.室温下,对于0.01mol•L-1的氨水,下列判断正确的是( )
| A. | 与少量Al2(SO4)3溶液反应的离子方程式为Al3++40H-═AlO2-+2H2O | |
| B. | 该溶液中滴入酚酞变红,是因NH3•H2O?NH4++0H- | |
| C. | 该溶液中Na+、NH4+、NO3-、Mg2+可大量共存 | |
| D. | 与少量CuSO4溶液反应的离子方程式:Cu2++2NH3•H2O═Cu(OH)2↓+2NH4+ |
5.下列表示方法正确的是( )
| A. | HCl的电子式为 | B. | N2的结构式 N≡N | ||
| C. | O原子处于基态的轨道表示式: | D. | 用电子式表示MgCl2的形成: |
15.下列各元素原子半径依次增大的是( )
| A. | Na、Mg、Al | B. | Na、O、F | C. | P、Si、Al | D. | C、Si、P |
20.化学科学需要借助化学专用语言来描述,下列有关化学用语正确的是( )
| A. | CO2的电子式:${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$$\underset{\stackrel{••}{C}}{••}$${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$ | |
| B. | 质量数为37的氯原子:${\;}_{37}^{17}$Cl | |
| C. | NH4Cl的电子式: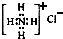 | |
| D. | 原子核内有10个中子的氧原子:${\;}_{8}^{18}$O |
 .
.
 实验室需要配制0.1 mol•L-1NaOH溶液500 mL,回答下列问题
实验室需要配制0.1 mol•L-1NaOH溶液500 mL,回答下列问题