题目内容
19.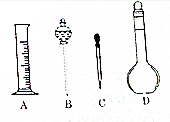 实验室需要配制0.1 mol•L-1NaOH溶液500 mL,回答下列问题
实验室需要配制0.1 mol•L-1NaOH溶液500 mL,回答下列问题(1)如同所示的仪器中配制溶液肯定不需要的是B(填序号).配制上述溶液还需用到的玻璃仪器是玻璃棒、烧杯 (填仪器名称).
(2)下列有关容量瓶用法的表述中正确的是A(填序号)
A.使用前需要检查玻璃塞处是否漏液
B.洗净后需烘干备用
C.直接加人氢氧化钠固体加水溶解
(3)配制该氢氧化钠溶液,需要用托盘天平称取NaOH固体2.0g
(4)实验中两次用到玻璃棒,其作用分别是搅拌加速溶解、引流.
分析 (1)根据操作步骤选取实验仪器;
(2)根据容量瓶的结构特点与使用原则解答;
(3)依据m=CVM计算需要溶质的质量;
(4)依据玻璃棒在溶解固体、转移液体时作用解答.
解答 解:(1)配制步骤有计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解(可用量筒量取水),冷却后转移到500mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的仪器为:托盘天平、药匙、烧杯、筒量、玻璃棒、容量瓶、胶头滴管,所以不需要的仪器是分液漏斗,还需要的仪器是烧杯和玻璃棒;
故答案为:B;玻璃棒、烧杯;
(2)A.容量瓶带有活塞,使用过程中需要上下颠倒,为防止漏水,使用前应检查是否漏水,故A正确;
B.定容时,仍然需要加入蒸馏水,所以使用前不需要干燥容量瓶,故B错误;
C.容量瓶为精密仪器,不能用来溶解固体,故C错误;
故选:A;
(3)配制0.1 mol•L-1NaOH溶液500 mL,需要氢氧化钠的质量m=0.1mol/L×40g/mol×0.5L=2.0g;
故答案为:2.0;
(4)在溶解固体时用玻璃棒搅拌加速固体溶解速率;转移液体时用玻璃棒引流;
故答案为:搅拌加速溶解;引流.
点评 本题考查一定物质的量浓度溶液的配制,难度不大,明确配制原理及操作步骤是解题关键,注意容量瓶构造及使用注意事项.

练习册系列答案
相关题目
9.下列实验操作、现象和结论均正确的是( )
| 选项 | 实验操作 | 现象 | 结论 |
| A | C2H4通入溴水中 | 溶液褪色 | C2H4跟Br2发生加成反应 |
| B | 向溶液X中滴入NaHCO3溶液 | 产生无色气体 | X中的溶质一定是酸 |
| C | Cl2通入品红溶液中 | 溶液褪色 | Cl2具有漂白性 |
| D | 分别向0.1mol•L-1醋酸和饱和硼酸溶液中滴加 0.1mol•L-1Na2CO3溶液 | 醋酸中有气泡产生, 硼酸中没有气泡产生 | 酸性:醋酸>碳酸>硼酸 |
| A. | A | B. | B | C. | C | D. | D |
10.下列反应可以设计成原电池的是( )
①CaO+H2O═Ca(OH)2
②Fe+H2SO4═FeSO4+H2↑
③2H2O═2H2↑+O2↑
④NaCl+AgNO3═AgCl↓+NaNO3
⑤Cu+2AgNO3═2Ag+Cu(NO3)2
⑥Fe+2FeCl3═3FeCl2.
①CaO+H2O═Ca(OH)2
②Fe+H2SO4═FeSO4+H2↑
③2H2O═2H2↑+O2↑
④NaCl+AgNO3═AgCl↓+NaNO3
⑤Cu+2AgNO3═2Ag+Cu(NO3)2
⑥Fe+2FeCl3═3FeCl2.
| A. | ①②④⑤⑥ | B. | ②③⑤⑥ | C. | ②⑤⑥ | D. | 全部 |
7.下列物质含有离子键的是( )
| A. | HCl | B. | NaCl | C. | N2 | D. | NO |
14.下列有关原电池的说法中正确的是( )
| A. | 在外电路中,电子由负极流向正极 | |
| B. | 在内电路中,电子由正极流向负极 | |
| C. | 原电池工作时,正极表面一定有气泡产生 | |
| D. | 原电池工作时,一定不会伴随着热能变化 |
11.分子式为C5H11Cl的有机物,分子中含2个甲基的同分异构体有(不含立体异构)( )
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
9.电子表中电子计算器的电源常用微型银锌原电池,其电极分别为Ag2O和Zn,电解质溶液为KOH溶液,放电时锌极上的电极反应是:Zn+2OH--2e-═Zn(OH)2;氧化银电极上的反应式为:Ag2O+H2O+2e-═Ag+2OH-,总反应式为:Ag2O+H2O+Zn═Zn(OH)2+2Ag.下列说法正确的是( )
| A. | 锌是阴极,氧化银是阳极 | |
| B. | 锌发生还原反应,氧化银发生氧化反应 | |
| C. | 溶液中OH-向Ag2O极移动,K+、H+向Zn极移动 | |
| D. | 随着电极反应的不断进行,电解质溶液的pH基本保持不变 |
 为了实现“将全球温度上升控制在2℃以内”,科学家正在研究温室气体CH4和CO2的转化和利用.
为了实现“将全球温度上升控制在2℃以内”,科学家正在研究温室气体CH4和CO2的转化和利用. ,Ni能与CO形成正四面体形的配合物Ni(CO)4,1molNi(CO)4中含有σ键的数目为8NA.
,Ni能与CO形成正四面体形的配合物Ni(CO)4,1molNi(CO)4中含有σ键的数目为8NA. 草酸二乙酯为无色油状液体,有芳香气味,主要用于医药工业中,是硫唑嘌呤、周效磺胺、羧苯脂青霉索等药物的中间体,已知它的结构如图所示:提示:
草酸二乙酯为无色油状液体,有芳香气味,主要用于医药工业中,是硫唑嘌呤、周效磺胺、羧苯脂青霉索等药物的中间体,已知它的结构如图所示:提示: