题目内容
18.室温下,对于0.01mol•L-1的氨水,下列判断正确的是( )| A. | 与少量Al2(SO4)3溶液反应的离子方程式为Al3++40H-═AlO2-+2H2O | |
| B. | 该溶液中滴入酚酞变红,是因NH3•H2O?NH4++0H- | |
| C. | 该溶液中Na+、NH4+、NO3-、Mg2+可大量共存 | |
| D. | 与少量CuSO4溶液反应的离子方程式:Cu2++2NH3•H2O═Cu(OH)2↓+2NH4+ |
分析 A.氨水为弱碱,反应生成的是氢氧化铝沉淀,且一水合氨不能拆开;
B.一水合氨在溶液中部分电离出氢氧根离子,所以氨水呈碱性;
C.镁离子与氢氧根离子反应生成氢氧化镁沉淀;
D.硫酸铜少量,氢氧化铜溶解,反应生成的是[Cu(NH3)4]2+.
解答 解:A.氨水为弱碱,反应生成氢氧化铝沉淀,正确的离子方程式为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故A错误;
B.该溶液中滴入酚酞变红,说明溶液呈碱性,一水合氨的电离方程式为:NH3•H2O?NH4++0H-,故B正确;
C.Mg2+与氨水中氢氧根离子反应生成氢氧化镁沉淀,在溶液中不能大量共存,故C错误;
D.氨水少量时的反应方程式为:CuSO4+2NH3•H2O=Cu(OH)2↓+(NH4)2SO4,氨水过量时氢氧化铜沉淀溶解:Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-,所以最终得到的是[Cu(NH3)4]2+,故D错误;
故选B.
点评 本题考查离子共存的正误判断、离子方程式的书写方法,为高考的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况,熟练掌握离子方程式的书写原则;试题侧重对学生基础知识的训练和检验,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力

练习册系列答案
 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案
相关题目
8.某校化学兴趣小组对以下种品牌牙膏中摩擦剂成分进行调查,结果如下表
试回答下列问题
(1)两面针儿童牙膏中摩擦剂成分与HCl溶液反应的离子方程式是Al(OH)3+3H+═Al3++3H2O
(2)中华透明牙膏摩擦剂与NaOH溶液反应的化学方程式是SiO2+2NaOH=Na2SiO3+H2O
(3)利用如图所示装罟(图中夹持仪器略去)进行实验充分反应后,分离出C装置中沉淀,经洗涤干燥称重,即可测定珍珠防臭牙膏样品中碳酸钙的质量分数.
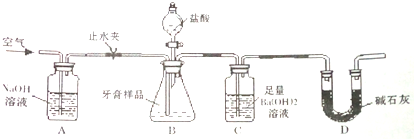
依据实验过程回答下列问题:
①试剂瓶D中碱石灰的作用是防止空气中的水蒸气、二氧化碳进入装置C中被氢氧化钡溶液吸收造成测定误差
②C中反应生成BaC03的离子方程式是CO2+Ba(OH)2═BaCO3↓+H2O.
③下列各项措施中,不能提高测定准确度的是cd(填标号)
a.经A装置通人空气排净装置内的CO2气体,并关闭止水夹
b.自分液漏斗滴加足量盐酸,滴加盐酸不宜过快
c.在A-B之间增添盛有浓硫酸的洗气装置
d.在B-C之间增添盛有饱和碳酸氢钠溶液的洗气装置
e.待B中无气泡冒出后,打开止水夹,经A装置继续通空气将装置中残余CO2排出
④准确称取珍珠防臭牙膏样品8.00g进行实验,测得BaCO3质量为3.94g,则该样品中碳酸钙的质量分数为25%
⑤有人认为不必测定C中生成的BaCO3质量,只要测定装置C在吸收CO2前后的质量差,一样以确定碳酸钙的质量分数,实验证明按此方法测定的结果明显偏高,原因是B中的水蒸气、氯化氢气体等进入装置C中.
| 牙膏品牌 | 两面针儿童牙膏 | 中华透明牙膏 | 珍珠防臭牙膏 |
| 摩擦剂 | 氢氧化铝 | 二氧化硅 | 碳酸钙 |
(1)两面针儿童牙膏中摩擦剂成分与HCl溶液反应的离子方程式是Al(OH)3+3H+═Al3++3H2O
(2)中华透明牙膏摩擦剂与NaOH溶液反应的化学方程式是SiO2+2NaOH=Na2SiO3+H2O
(3)利用如图所示装罟(图中夹持仪器略去)进行实验充分反应后,分离出C装置中沉淀,经洗涤干燥称重,即可测定珍珠防臭牙膏样品中碳酸钙的质量分数.

依据实验过程回答下列问题:
①试剂瓶D中碱石灰的作用是防止空气中的水蒸气、二氧化碳进入装置C中被氢氧化钡溶液吸收造成测定误差
②C中反应生成BaC03的离子方程式是CO2+Ba(OH)2═BaCO3↓+H2O.
③下列各项措施中,不能提高测定准确度的是cd(填标号)
a.经A装置通人空气排净装置内的CO2气体,并关闭止水夹
b.自分液漏斗滴加足量盐酸,滴加盐酸不宜过快
c.在A-B之间增添盛有浓硫酸的洗气装置
d.在B-C之间增添盛有饱和碳酸氢钠溶液的洗气装置
e.待B中无气泡冒出后,打开止水夹,经A装置继续通空气将装置中残余CO2排出
④准确称取珍珠防臭牙膏样品8.00g进行实验,测得BaCO3质量为3.94g,则该样品中碳酸钙的质量分数为25%
⑤有人认为不必测定C中生成的BaCO3质量,只要测定装置C在吸收CO2前后的质量差,一样以确定碳酸钙的质量分数,实验证明按此方法测定的结果明显偏高,原因是B中的水蒸气、氯化氢气体等进入装置C中.
9.下列实验操作、现象和结论均正确的是( )
| 选项 | 实验操作 | 现象 | 结论 |
| A | C2H4通入溴水中 | 溶液褪色 | C2H4跟Br2发生加成反应 |
| B | 向溶液X中滴入NaHCO3溶液 | 产生无色气体 | X中的溶质一定是酸 |
| C | Cl2通入品红溶液中 | 溶液褪色 | Cl2具有漂白性 |
| D | 分别向0.1mol•L-1醋酸和饱和硼酸溶液中滴加 0.1mol•L-1Na2CO3溶液 | 醋酸中有气泡产生, 硼酸中没有气泡产生 | 酸性:醋酸>碳酸>硼酸 |
| A. | A | B. | B | C. | C | D. | D |
13.某有机样品3.1g完全燃烧,燃烧后的混合物通入过量的澄清石灰水,石灰水共增重7.1g,经过滤得到10g沉淀.该有机样品可能是( )
| A. | 乙二醇 | B. | 乙醇 | C. | 乙醛 | D. | 丙三醇 |
10.下列反应可以设计成原电池的是( )
①CaO+H2O═Ca(OH)2
②Fe+H2SO4═FeSO4+H2↑
③2H2O═2H2↑+O2↑
④NaCl+AgNO3═AgCl↓+NaNO3
⑤Cu+2AgNO3═2Ag+Cu(NO3)2
⑥Fe+2FeCl3═3FeCl2.
①CaO+H2O═Ca(OH)2
②Fe+H2SO4═FeSO4+H2↑
③2H2O═2H2↑+O2↑
④NaCl+AgNO3═AgCl↓+NaNO3
⑤Cu+2AgNO3═2Ag+Cu(NO3)2
⑥Fe+2FeCl3═3FeCl2.
| A. | ①②④⑤⑥ | B. | ②③⑤⑥ | C. | ②⑤⑥ | D. | 全部 |
7.下列物质含有离子键的是( )
| A. | HCl | B. | NaCl | C. | N2 | D. | NO |
 草酸二乙酯为无色油状液体,有芳香气味,主要用于医药工业中,是硫唑嘌呤、周效磺胺、羧苯脂青霉索等药物的中间体,已知它的结构如图所示:提示:
草酸二乙酯为无色油状液体,有芳香气味,主要用于医药工业中,是硫唑嘌呤、周效磺胺、羧苯脂青霉索等药物的中间体,已知它的结构如图所示:提示: