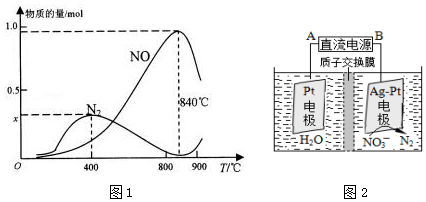
题目内容
11. 电解原理在工业生产中应用广泛.
电解原理在工业生产中应用广泛.(1)电解法生产MnO2的方法是以石墨为电极,电解酸化的MnSO4溶液.MnO2在阳极产生,若电解电路中通过2mol电子,则MnO2的理论产量为87 g.
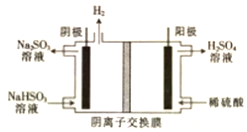
(2)工业二氧化硫尾气用Na2SO3吸收后转化为NaHSO3溶液,再用惰性电极电解NaHSO3 溶液,可在生产硫酸的同时再生成 Na2SO3. 原理如图所示.
①电解总反应方程式是2NaHSO3+H2O$\frac{\underline{\;通电\;}}{\;}$H2SO4+Na2SO3+H2↑.
②阳极区可能放出SO2,分析其产生的原因:.
分析 (1)电解酸化的MnSO4溶液时,根据离子的放电顺序,阴极上首先放电的是H+,电极反应式为:2H++2e-=H2↑,阳极反应式为:MnSO4-2e-+2H2O═MnO2+SO42-+4H+,若电路中通过2mol电子产生1molMnO2,质量为87g;
(2)电解NaHSO3溶液可在生产硫酸的同时再生成Na2SO3,硫的化合价升高,所以阳极是HSO3-溶液失去电子被氧化生成SO42-,阴极为氢离子得电子生成氢气,据此书写总反应;电解过程中,阳极区可能发生反应:HSO3-+H+=SO2↑+H2O.
解答 解:(1)阳极反应式为:MnSO4-2e-+2H2O═MnO2+SO42-+4H+,因为MnSO4~MnO2~2e-,通过2mol电子产生1molMnO2,其质量为87g.
故答案为:阳;87;
(2)电解池中阳极失去电子,发生氧化反应,电解NaHSO3溶液可在生产硫酸的同时再生成Na2SO3,硫的化合价升高,所以阳极是HSO3-溶液失去电子被氧化生成SO42-,阴极为氢离子得电子生成氢气,所以电解总反应方程式是2NaHSO3+H2O$\frac{\underline{\;通电\;}}{\;}$H2SO4+Na2SO3+H2↑;电解过程中,HSO3-通过阴离子交换膜进入阳极区,再与H+发生反应:HSO3-+H+=SO2↑+H2O,产生SO2,
故答案为:2NaHSO3+H2O$\frac{\underline{\;通电\;}}{\;}$H2SO4+Na2SO3+H2↑;电解过程中,HSO3-通过阴离子交换膜进入阳极区,再与H+发生反应:HSO3-+H+=SO2↑+H2O,产生SO2.
点评 本题考查了原电池电极反应和电解池原理的理解应用,侧重于学生的分析能力的考查,难度中等.

| A. | 氯化钠溶液 | B. | 食盐水 | C. | 牛奶 | D. | 碘酒 |
| A. | 稀硫酸滴在铜片上:Cu+2H+═Cu2++H2O | |
| B. | 氧化镁与稀盐酸混合:MgO+2H+═Mg2++H2O | |
| C. | 铜片插入硝酸银溶液中:Cu+Ag+═Cu2++Ag | |
| D. | 稀硝酸滴在石灰石上:CaCO3+2H+═Ca2++H2CO3 |
| A. | 用惰性电极电解NaH2PO2溶液,其阳极反应式为2H2O-4e-=O2↑+4H+ | |
| B. | 将H3PO2溶液加入到酸性重铬酸钾溶液中,H3PO2的还原产物可能为H3PO4 | |
| C. | H3PO2溶于水的电离方程式为H3PO2?H++H3PO2- | |
| D. | H3PO2与过量NaOH溶液反应的离子方程式为H3PO2+3OH-=PO23-+3H2O |

上述反应产生的能量传递给荧光染料分子后,使染料分子释放出荧光.下列说法正确的是( )
| A. | 上述反应是酯的水解反应 | |
| B. | 荧光棒发光过程涉及化学能到光能的转化 | |
| C. | 二苯基草酸酯苯环上的一氯代物共有4种 | |
| D. | 二苯基草酸酯与草酸(  )互为同系物 )互为同系物 |
| A. | TiO2是氧化剂 | |
| B. | 四氯化钛是还原产物 | |
| C. | Cl2发生氧化反应 | |
| D. | 氧化剂与还原剂的物质的量之比为1:2 |
实验(一) 碘含量的测定
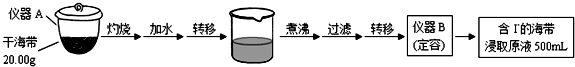
取0.0100mol•Lˉ1的AgNO3标准溶液装入滴定管,取100.00mL海带浸取原液至滴定池,用电势滴定法测定碘含量.测得的电动势(E)反映溶液中c(Iˉ)的变化,部分数据如下表:
| V(AgNO3)/mL | 15.00 | 19.00 | 19.80 | 19.98 | 20.00 | 20.02 | 21.00 | 23.00 | 25.00 |
| E/mV | -225 | -200 | -150 | -100 | 50.0 | 175 | 275 | 300 | 325 |
另制海带浸取原液,甲、乙两种实验方案如下:
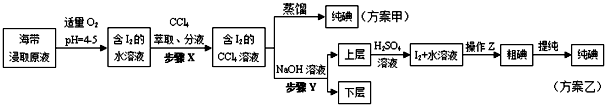
已知:3I2+6NaOH=5NaI+NaIO3+3H2O.
(1)实验(一) 中的仪器名称:仪器A坩埚,仪器B500mL容量瓶.
(2)①根据表中数据绘制滴定曲线:
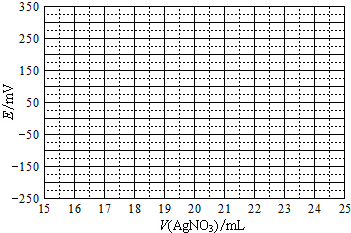
②该次滴定终点时用去AgNO3溶液的体积为20.00mL,计算得海带中碘的百分含量为0.635%.(已知碘的相对原子质量为127)
(3)①分液漏斗使用前须检漏,检漏方法为向分液漏斗中加入少量水,检查旋塞处是否漏水;将漏斗倒转过来,检查玻璃塞是否漏水.
②步骤X中,萃取后分液漏斗内观察到的现象是液体分上下两层,下层呈紫红色.
③下列有关步骤Y的说法,正确的是AB.
A.应控制NaOH溶液的浓度和体积 B.将碘转化呈离子进入水层
C.主要是除去海带浸取原液中的有机杂质 D.NaOH溶液可以由乙醇代替
④实验(二) 中操作Z的名称是过滤.
(4)方案甲中采用蒸馏不合理,理由是碘单质易升华,会导致碘损失.