题目内容
以下表述不符合元素周期律观点的是( )
| A、酸性:H3PO4>HNO3>HClO4 |
| B、稳定性:HF>H2O>NH3 |
| C、微粒半径:F->Na+>Mg2+ |
| D、碱性:KOH>NaOH>Mg(OH)2 |
考点:非金属在元素周期表中的位置及其性质递变的规律,金属在元素周期表中的位置及其性质递变的规律,微粒半径大小的比较
专题:元素周期律与元素周期表专题
分析:A.根据元素的非金属性越强其对应的最高价氧化物对应的水化物的酸性越强;
B.根据非金属性越强,则对应的氢化物的稳定性越大;
C.根据核外电子排布相同时,核电核数越大,半径越小;
D.元素的金属性越强,对应的最高价氧化物的水化物的碱性越强.
B.根据非金属性越强,则对应的氢化物的稳定性越大;
C.根据核外电子排布相同时,核电核数越大,半径越小;
D.元素的金属性越强,对应的最高价氧化物的水化物的碱性越强.
解答:
解:A.因元素的非金属性越强其对应的最高价氧化物对应的水化物的酸性越强,非金属性:Cl>S>P,酸性:HClO4>H2SO4>H3PO4,故A错误;
B.因元素的非金属性越强,则对应的氢化物的稳定性越大,非金属性:F>O>N,稳定性:HF>H2O>NH3,故B正确;
C.核外电子排布相同,核电核数越大,半径越小,正确顺序为:F->Na+>Mg2+,故C正确;
D.金属性:K>Na>Mg,元素的金属性越强,对应的最高价氧化物的水化物的碱性越强,则碱性:KOH>NaOH>Mg(OH)2,故D正确;
故选A.
B.因元素的非金属性越强,则对应的氢化物的稳定性越大,非金属性:F>O>N,稳定性:HF>H2O>NH3,故B正确;
C.核外电子排布相同,核电核数越大,半径越小,正确顺序为:F->Na+>Mg2+,故C正确;
D.金属性:K>Na>Mg,元素的金属性越强,对应的最高价氧化物的水化物的碱性越强,则碱性:KOH>NaOH>Mg(OH)2,故D正确;
故选A.
点评:本题考查元素金属性、非金属性的递变规律以及离子半径大小的比较,题目难度不大,注意把握元素周期律的递变规律即可.

练习册系列答案
相关题目
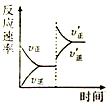 一定条件下,在某密闭容器中进行如下反应:mA(g)+nB(g)?pC(g)+qD(s),若增大压强或升高温度,重新达到平衡,反应速率随时间的变化过程如图所示,则对该反应的叙述正确的是( )
一定条件下,在某密闭容器中进行如下反应:mA(g)+nB(g)?pC(g)+qD(s),若增大压强或升高温度,重新达到平衡,反应速率随时间的变化过程如图所示,则对该反应的叙述正确的是( )| A、正反应是放热反应 |
| B、逆反应是放热反应 |
| C、m+n<p+q |
| D、m+n>p+q |
下列关于反应2S02(g)+O2(g)?2S03(g)△H<0的说法正确的是( )
| A、升温可以加快合成SO3的速率同时提高SO2的转化率 |
| B、寻找常温下的合适催化剂是未来研究的方向 |
| C、由于△H<0,△S<0,故该反应一定能自发进行 |
| D、当v(O2)生成?2v(SO3)消耗时,说明反应达到平衡状态 |
常温下,分别将四块形状相同,质量均为7g的铁片同时放入下列四种溶液中,产生H2的速率最快的是( )
| A、500mL2mol?L-1稀硫酸 |
| B、150mL5mol?L-1稍酸 |
| C、50mL3mol?L-1盐酸 |
| D、500mL2mol?L-1稀硫酸和少量硫酸铜 |
已知热化学方程式2H2(g)+O2(g)=2H2O(l)△H1<0;2H2O(g)=2H2(g)+O2(g)△H2.下列说法正确的是( )
| A、方程式中化学计量数表示分子数 |
| B、△H2>0 |
| C、△H2=-△H1 |
| D、利用△H1,△H2可求出水的气化热 |
下列说法正确的是( )
| A、干冰升华要吸收大量的热,这就是化学反应中的吸热反应 |
| B、凡是在加热或点燃条件下进行的反应都是吸热反应 |
| C、人们用氢氧焰焊接或切割金属,主要是利用了氢气和氧气化合时所放出的能量 |
| D、明矾有净水作用,所以用明矾处理硬水,可以使硬水软化 |
按“单质、氧化物、盐”的顺序排列的一组物质是( )
| A、SO2 S Na2SO4 |
| B、Si SiO2 Na2SiO3 |
| C、CO2 Na2CO3 C |
| D、Al Al2O3 Al(OH)3 |
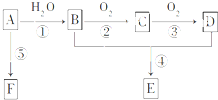 已知A是一种相对分子质量为42的气态烃,它可转化为其他常见有机物,转化关系如图所示.
已知A是一种相对分子质量为42的气态烃,它可转化为其他常见有机物,转化关系如图所示.