题目内容
25℃时,在BaSO4的饱和溶液中存在:BaSO4(s)?Ba2+(aq)+SO42-(aq),Ksp=1.1025×10-10,在该温度下有关BaSO4的溶度积和溶解平衡的叙述正确的是( )
| A、向c(SO42-)=1.05×10-5mol/L的BaSO4溶液中加入BaSO4固体,c(SO42-)增大 |
| B、向该饱和溶液中加入Ba(NO3)2固体,则BaSO4的溶度积常数增大 |
| C、向该饱和溶液中加入Na2SO4固体,则该溶液中c(Ba2+)>c(SO42-) |
| D、向该饱和溶液中加入BaCl2固体,则该溶液中c(SO42-)减小 |
考点:难溶电解质的溶解平衡及沉淀转化的本质
专题:电离平衡与溶液的pH专题
分析:A、在BaSO4的饱和溶液,加入BaSO4固体,由于溶液已经饱和,c(SO42-)保持不变;
B、Ksp是一常数,温度不变Ksp不变;
C、向该饱和溶液中加入Na2SO4固体,c(SO42-)>c(Ba2+);
D、硫酸钡溶液中存在着溶解平衡,加入BaCl2固体,平衡左移,c(SO42-)降低.
B、Ksp是一常数,温度不变Ksp不变;
C、向该饱和溶液中加入Na2SO4固体,c(SO42-)>c(Ba2+);
D、硫酸钡溶液中存在着溶解平衡,加入BaCl2固体,平衡左移,c(SO42-)降低.
解答:
解:A、在BaSO4的饱和溶液,加入BaSO4固体,由于溶液已经饱和,c(SO42-)保持不变,故A错误;
B、Ksp是一常数,温度不变Ksp不变,故B错误;
C、向该饱和溶液中加入Na2SO4固体,则该溶液中c(SO42-)>c(Ba2+),故C错误;
D、硫酸钡溶液中存在着溶解平衡,加入BaCl2固体,会增大c(Ba2+),平衡左移,c(SO42-)降低,故D正确.
故选D.
B、Ksp是一常数,温度不变Ksp不变,故B错误;
C、向该饱和溶液中加入Na2SO4固体,则该溶液中c(SO42-)>c(Ba2+),故C错误;
D、硫酸钡溶液中存在着溶解平衡,加入BaCl2固体,会增大c(Ba2+),平衡左移,c(SO42-)降低,故D正确.
故选D.
点评:本题考查沉淀溶解平衡,题目难度中等,注意理解难溶电解质在水中的沉淀溶解平衡特点,正确理解和掌握溶度积Ksp的概念.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
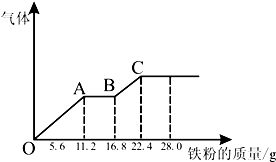 某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份,向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体),向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图,下列分析或结果错误的是( )
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份,向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体),向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图,下列分析或结果错误的是( )| A、H2SO4浓度为4mol?L-1 |
| B、OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生氢气 |
| C、每份混合酸中NO3-物质的量为0.3mol |
| D、第二份溶液中最终溶质为FeSO4 |
一定量的盐酸跟过量的铁粉反应时,为了减缓反应速率但不影响生成H2的总量,可向盐酸中加入适量的( )
| A、CaCO3(s) |
| B、Na2SO4溶液 |
| C、KNO3溶液 |
| D、CuSO4(s) |

 某学习小组用0.10mol?L-1的标准NaOH溶液滴定20.00mL某未知浓度的酸HA,指示剂变色时认为酸碱恰好反应,此时测得溶液的pH为8.7.该小组绘制的滴定曲线如图:
某学习小组用0.10mol?L-1的标准NaOH溶液滴定20.00mL某未知浓度的酸HA,指示剂变色时认为酸碱恰好反应,此时测得溶液的pH为8.7.该小组绘制的滴定曲线如图: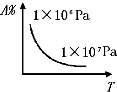

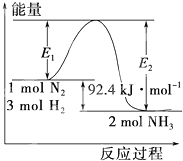 合成氨工业的核心反应是:N2(g)+3H2(g)
合成氨工业的核心反应是:N2(g)+3H2(g)