题目内容
NO会继续快速被氧化为NO2,又已知:2NO2 (g)?N2O4 (g)△H<0
①现取五等份NO2,分别加入温度不同、容积相同的恒容密闭容器中,发生反应:2NO2(g)?N2O4(g).反应相同时间后,分别测定体系中NO2的百分含量(NO2%),并作出其随反应温度(T)变化的关系图.下列示意图中,可能与实验结果相符的是 .

②保持温度体积不变,向上述平衡体系中再通入一定量的NO2,则达平衡时NO2的转化率 (填增大、减小、不变、无法确定).
①现取五等份NO2,分别加入温度不同、容积相同的恒容密闭容器中,发生反应:2NO2(g)?N2O4(g).反应相同时间后,分别测定体系中NO2的百分含量(NO2%),并作出其随反应温度(T)变化的关系图.下列示意图中,可能与实验结果相符的是

②保持温度体积不变,向上述平衡体系中再通入一定量的NO2,则达平衡时NO2的转化率
考点:氮的氧化物的性质及其对环境的影响,化学平衡的影响因素
专题:化学平衡专题,元素及其化合物
分析:①在恒容状态下,在五个相同的容器中同时通入等量的NO2,反应相同时间.达到平衡状态之前,温度越高,反应速率越大,导致NO2的百分含量越小;达到平衡后,因为该反应是放热反应,升高温度,平衡向逆反应方向移动,NO2的百分含量随温度升高而升高;在D图中转折点为平衡状态,转折点左侧为平衡状态之前,右侧为平衡状态;
②保持温度体积不变,向上述平衡体系中再通入一定量的NO2,相当增大压强.
②保持温度体积不变,向上述平衡体系中再通入一定量的NO2,相当增大压强.
解答:
解:①A、因为该反应是放热反应,温度越高,平衡向逆反应方向移动,NO2的百分含量随温度升高而升高,故A错误;
B、因为该反应是放热反应,温度越高,平衡向逆反应方向移动,NO2的百分含量随温度升高而升高,故B正确;
C、若5个容器中有未达到平衡状态的,那么温度越高,反应速率越大,会出现温度高的NO2转化得快,导致NO2的百分含量少的情况,不可能出现NO2的百分含量不变的情况,故C错误;
D、在D图中转折点为平衡状态,转折点左则为未平衡状态,右则为平衡状态,反应是放热反应,温度升高,平衡向逆反应方向移动,故D正确;
故选BD;
②保持温度体积不变,向上述平衡体系中再通入一定量的NO2,相当增大压强,平衡正向移动,故答案为:增大.
B、因为该反应是放热反应,温度越高,平衡向逆反应方向移动,NO2的百分含量随温度升高而升高,故B正确;
C、若5个容器中有未达到平衡状态的,那么温度越高,反应速率越大,会出现温度高的NO2转化得快,导致NO2的百分含量少的情况,不可能出现NO2的百分含量不变的情况,故C错误;
D、在D图中转折点为平衡状态,转折点左则为未平衡状态,右则为平衡状态,反应是放热反应,温度升高,平衡向逆反应方向移动,故D正确;
故选BD;
②保持温度体积不变,向上述平衡体系中再通入一定量的NO2,相当增大压强,平衡正向移动,故答案为:增大.
点评:本题考查化学反应速率、平衡移动原理及其应用,题目难度中等,注意温度对平衡移动的影响.

练习册系列答案
相关题目
 某同学如图所示装置进行实验,当滴入液体后出现气球体积缩小了,则使用的固体和液体试剂可能是( )
某同学如图所示装置进行实验,当滴入液体后出现气球体积缩小了,则使用的固体和液体试剂可能是( )| A、铜与浓硫酸 |
| B、铁与浓硫酸 |
| C、铝和氢氧化钠溶液 |
| D、二氧化锰和浓盐酸 |
在指定环境中,下列各组离子或分子可以大量共存的是( )
| A、常温下,pH<7的溶液中:SO32-、Cu2+、HClO、K+ |
| B、加入铝粉后产生大量氢气的溶液中:Fe3+、Na+、NO3-、SO42- |
| C、无色透明溶液中:[Ag(NH3)2]+、NH3?H2O、OH-、NO3- |
| D、常温下,水电离出的c(H+)=10-14 mol?L-1的溶液中:Na+、Ca2+、Br-、HCO3- |
在一定温度下,反应PCl3(g)+Cl2 (g)PCl5(g)的平衡常数为6.若将1.0mol的PCl5(g)通入体积为1.0L的密闭容器中,在该温度时PCl5(g)的最大分解率接近于( )
| A、33% | B、50% |
| C、67% | D、75% |
某无色透明溶液含有下列离子中的几种:Mg2+、Cu2+、Ba2+、H+、SO42-、OH-、NO3-、HCO3-,在其中加入金属铁,发生反应放出气体只有H2.试判断上述离子中一定不能大量存在于此溶液中的有( )
| A、2种 | B、5种 | C、4种 | D、6种 |
下列叙述一定正确的是( )
| A、HF、HCl、HBr、HI四种物质的稳定性逐渐减弱,但沸点不是依次升高 |
| B、烷烃的沸点随碳原子数的增加而升高,一氯代烷的密度随烃基中碳原子数的增加而增大 |
| C、原子晶体中各相邻原子之间都以共价键结台,分子晶体中的每个分子内都含有共价键 |
| D、干冰和氯化铵分别受热变为气体所克服的粒子间相互作用力属于同种类型 |
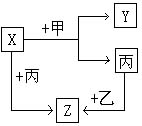 如图所示,甲、乙、丙、是三种常见单质,x、y、z是常见的三种化合物,它们之间有如下转化关系:
如图所示,甲、乙、丙、是三种常见单质,x、y、z是常见的三种化合物,它们之间有如下转化关系: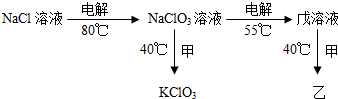 氯元素的常见化合价有-1,0,+1,+3,+4,+5,+7.
氯元素的常见化合价有-1,0,+1,+3,+4,+5,+7.