��Ŀ����
 ��Ԫ�صij������ϼ���-1��0��+1��+3��+4��+5��+7��
��Ԫ�صij������ϼ���-1��0��+1��+3��+4��+5��+7����KClO3��һ��ǿ�������������½��ȶ�����400��������ֽⲢ�ų���������ֽ��Ϊ�������У����ȵ�356������ʱ�ֽ�Ϊ���ң����������ų����������¶���400������ʱ���ҷֽ�Ϊ�ͱ������м���һ�ֺ��ȵĻ����
����֪�����ﶡ�ɱ��������Ԫ�غ���Ԫ����ɣ���һ�ֺ��ɫ��ǿ�Ҵ̼��Գ�ζ�����壬��״�����ܶ�ԼΪ3.01g?L-1��
��1���ĵ���ʽΪ
��2��ʵ���ҿ�����KClO3��Ũ�����Ʊ���������Ӧ�ķ���ʽΪ
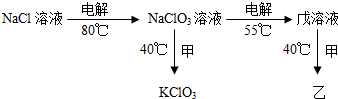
��3����ҵ��KClO3���Ҿ��ɵ����ֽ�������Ӧ�Ƶã�������������ͼ��ʾ������ȵ�NaCl��Һʱ��������Cl2��NaOH��Ӧ����NaClO3��NaCl��NaCl��������缫��Ӧ������ʵ����NaClO3��ת����д���õ����з������ܷ�Ӧ����ʽ
| �������ʵ�ʲ��� |
| ���۲��� |
��4��д�����NaClO3������ʱ��������Ӧʽ
��5��NaClO3�������ڶ�����������NaClO3��Һ��H2SO4�ữ��ͨ��SO2�����Ƶã���д�����������ӷ�Ӧ����ʽ
���㣺�Ƶ���Ҫ������,���ԭ��
ר�⣺
���������������֪�������400��������ֽⲢ�ų����������Ȼ��أ��ֽ��Ϊ�������У����ȵ�356������ʱ�ֽ�Ϊ�Ȼ��غ�����أ�����������ȷֽ������Ȼ��غ�����������ԭ�Ӹ����غ���ͼ��ת����֪��Ϊ�Ȼ��أ���Ϊ������أ���Ϊ���������ݶ���״�����ܶ�ԼΪ3.01g?L-1����֪M������=3.01g?L-1��22.4L/mol=67.4g/mol����֪��Ϊ�������ȣ��ݴ˷������
���
�⣺��1���Ȼ���Ϊ���ӻ�������ɼ�������������ͨ�����Ӽ��γɣ�����ʽΪ��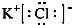 �� ��������������ڸ����·ֽ������Ȼ��غ������֪����������ȶ���ǿ������أ�����KClO3��KClO4���ʴ�Ϊ��
�� ��������������ڸ����·ֽ������Ȼ��غ������֪����������ȶ���ǿ������أ�����KClO3��KClO4���ʴ�Ϊ��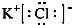 ��KClO3��KClO4��
��KClO3��KClO4��
��2��������ؾ���ǿ�������ԣ��ܹ������Ȼ����е������ӣ���Ӧ�Ļ�ѧ����ʽΪ��KClO3+6HCl��Ũ��=KCl+3Cl2��+3H2O��
�ʴ�Ϊ��KClO3+6HCl��Ũ��=KCl+3Cl2��+3H2O��
��3������Ȼ�����Һ�����������ƺ���������������ѧ����ʽΪ��2NaCl+2H2O=2NaOH+H2��+Cl2���٣��������ȵ��������Ʒ�����Ӧ��6NaOH+3Cl2
5NaCl+NaClO3+3H2O�ڣ��١�3+�ڵã�NaCl+3H2O
NaClO3+3H2����
���������117gNaCl�����ʵ���=
=2mol��������NaClOΪxmol������ΪNaClO3mol����x+y=2����·��ת�Ƶĵ���Ϊ10.4mol����2x+6y=10.4����ã�y=1.6mol��x=0.4mol������ԭ�Ӹ����غ㣬����Ȼ���ȫ��ת��ΪNaClO3����NaClO3�����ʵ���Ϊ2mol������NaClO3�IJ���
��100%=
80%��
�ʴ�Ϊ��NaCl+3H2O
NaClO3+3H2����80%��
��4�����NaClO3���ɸ������ƣ��������������ʧȥ�������ɸ���������ӣ��缫��ӦʽΪ��ClO3--2e-+2OH-=ClO4-+H2O��
�ʴ�Ϊ��ClO3--2e-+2OH-=ClO4-+H2O��
��5�����ݶ���״�����ܶ�ԼΪ3.01g?L-1����֪M������=3.01g?L-1��22.4L/mol=67.4g/mol����֪��Ϊ�������ȣ�NaClO3��Һ��H2SO4�ữ��ͨ��SO2���壬������Ӧ���ɶ������Ⱥ������ƣ����ݵ�ʧ�����غ���ƽ��ѧ����ʽΪ��2ClO3-+SO2=2ClO2+SO42-��
�ʴ�Ϊ��2ClO3-+SO2=2ClO2+SO42-��
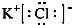 �� ��������������ڸ����·ֽ������Ȼ��غ������֪����������ȶ���ǿ������أ�����KClO3��KClO4���ʴ�Ϊ��
�� ��������������ڸ����·ֽ������Ȼ��غ������֪����������ȶ���ǿ������أ�����KClO3��KClO4���ʴ�Ϊ��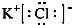 ��KClO3��KClO4��
��KClO3��KClO4����2��������ؾ���ǿ�������ԣ��ܹ������Ȼ����е������ӣ���Ӧ�Ļ�ѧ����ʽΪ��KClO3+6HCl��Ũ��=KCl+3Cl2��+3H2O��
�ʴ�Ϊ��KClO3+6HCl��Ũ��=KCl+3Cl2��+3H2O��
��3������Ȼ�����Һ�����������ƺ���������������ѧ����ʽΪ��2NaCl+2H2O=2NaOH+H2��+Cl2���٣��������ȵ��������Ʒ�����Ӧ��6NaOH+3Cl2
| ||
| ||
| 80�� |
���������117gNaCl�����ʵ���=
| 117g |
| 58.5g/mol |
| 1.6mol |
| 2mol |
80%��
�ʴ�Ϊ��NaCl+3H2O
| ||
| 80�� |
��4�����NaClO3���ɸ������ƣ��������������ʧȥ�������ɸ���������ӣ��缫��ӦʽΪ��ClO3--2e-+2OH-=ClO4-+H2O��
�ʴ�Ϊ��ClO3--2e-+2OH-=ClO4-+H2O��
��5�����ݶ���״�����ܶ�ԼΪ3.01g?L-1����֪M������=3.01g?L-1��22.4L/mol=67.4g/mol����֪��Ϊ�������ȣ�NaClO3��Һ��H2SO4�ữ��ͨ��SO2���壬������Ӧ���ɶ������Ⱥ������ƣ����ݵ�ʧ�����غ���ƽ��ѧ����ʽΪ��2ClO3-+SO2=2ClO2+SO42-��
�ʴ�Ϊ��2ClO3-+SO2=2ClO2+SO42-��
����������Ϊ����ͼ�ƶϣ���Ŀ�ѶȽϴ��ؿ���������ԭ��Ӧ���ɡ����ع���ԭ����ȷ���ո�����Ϣ����Ϥ��ͼ������ת���Ĺ�ϵ�ǽ���ؼ���

��ϰ��ϵ�д�
�����Ŀ
������������ȷ���ǣ�������
A��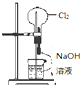 �� ����ѹ��ͷ�ιܺ�ῴ����ƿ���γ���Ȫ |
B��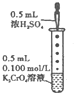 �μӼ���ŨH2SO4����Һ��ɫ�ɻ�ɫ��Ϊ��ɫ |
C��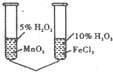 �ɸ�ʵ�������֤�����Ĵ�Ч�� |
D��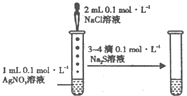 ����֤AgCl������ת��Ϊ�ܽ�ȸ�С��Ag2S���� |
���в���������ȡ���ǣ�������
| A������Ķ���̼��Һ�����ˮ�� |
| B������ˮ��������� |
| C�����ˮ��Ӿƾ��� |
| D�������ú����Һ��Ӽױ��� |
2012�꣬����ý�屨���ˡ������ҡ��¼������������ù�ҵ��������ʳ�������Ʊ�ҩ�ý��ң������ؽ������ĺ������꣬����Σ�����彡������ҵ�����Ƕ���Ƥ�������ƺ�õ��ģ�����˵������ȷ���ǣ�������
| A��Ƥ�����ƹ�����ʹ�õ�K2Cr2O7��ʹ���������� |
| B����������Ҫ�ɷ��ǵ����� |
| C�������Խ���ҵ���������̷�������̷��е����ʵĺ��� |
| D��ʳ�����������������ԭ���ȣ�������ʳƷ���Ӽ� |
��֪���ױ������ϵ�һ�������6��ͬ���칹�壬���ļױ������ϵ�������У�������
| A��3�� | B��6�� | C��2�� | D��4�� |
���б仯������뻹ԭ�����ǣ�������
| A��HCO3-��CO2 |
| B��FeO��Fe3O4 |
| C��KClO3��KCl |
| D��MnO4-��Mn2+ |




