题目内容
10.水(H2O)在很多化学反应中具有极其重要的作用.请研究下列水参与的氧化还原反应.①NaH+H2O═NaOH+H2↑
②2Na2O2+2H2O═4NaOH+O2↑
③Na+2H2O═2NaOH+H2↑
④3NO2+H2O═2HNO3+NO
⑤2H2O $\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑
⑥2F2+2H2O═4HF+O2
水只作氧化剂的是①③;水只作还原剂的是⑥;水既作氧化剂,又作还原剂的是⑤;水既不作氧化剂,又不是还原剂的是②④.
分析 水只作氧化剂,说明水中元素只得电子化合价降低;水只作还原剂说明水中元素只失电子化合价升高;水既做氧化剂,又做还原剂说明水中元素既有得电子化合价降低的又有失电子化合价升高的;水既不是氧化剂,又不是还原剂,说明水中各元素化合价不变.
解答 解:①NaH+H2O=NaOH+H2↑中NaH中H元素化合价由-1价变为0价、水中H元素化合价由+1价变为0价,所以水只作氧化剂;
②2Na2O2+2H2O=4NaOH+O2↑中过氧化钠中O元素化合价由-1价变为0价和-2价,所以过氧化钠既是氧化剂又是还原剂,水中各元素化合价不变,则水既不是氧化剂又不是还原剂;
③2Na+2H2O=2NaOH+H2↑中Na元素化合价由0价变为+1价、水中H元素化合价由+1价变为0价,所以水只作氧化剂;
④3NO2+H2O=2HNO3+NO中N元素化合价由+4价变为+5价、+2价,水中各元素化合价不变,所以水既不是氧化剂又不是还原剂;
⑤2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑中H元素化合价由+1价变为0价、O元素化合价由-2价变为0价,所以水既是氧化剂又是还原剂;
⑥2F2+2H2O=4HF+O2 中F元素化合价由0价变为-1价、O元素化合价由-2价变为0价,所以水只作还原剂;
水只做氧化剂的是①③,水只做还原剂的是⑥;水既做氧化剂,又做还原剂的是⑥;水既不是氧化剂,又不是还原剂的是③⑤;
故答案为:①③;⑥;⑤;②④.
点评 本题考查氧化还原反应,侧重基本概念,明确元素化合价变化是解本题关键,熟练掌握常见元素化合价,注意氟气和水的反应、过氧化钠中O元素化合价,题目难度不大.

练习册系列答案
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案
相关题目
20.下列各组中的两种物质作用,反应条件(温度或反应物用量或浓度)改变,不会引起产物种类改变的是( )
| A. | Na和O2 | B. | Cu和HNO3 | C. | Na2O2和CO2 | D. | AlCl3和NaOH |
1.能与碳酸钠溶液反应产生气体的物质是( )
| A. | 苯 | B. | 甲烷 | C. | 乙烯 | D. | 乙酸 |
5.钠与水反应时的现象中与钠的下列性质无关的是( )
| A. | 钠的熔点低 | B. | 钠的密度小 | C. | 钠的硬度小 | D. | 有强还原性 |
15.现有①硫酸镁 ②硝酸钡 ③氢氧化钠 ④氯化铜 ⑤氯化钾 五种溶液,不用任何其他试剂也可鉴别,且鉴别出来的先后顺序正确的是( )
| A. | ④③①②⑤ | B. | ④⑤③②① | C. | ④③②①⑤ | D. | ④②③①⑤ |
2.用锌,氧化铜,稀硫酸作原料制取铜时,有下列两种途径:
(1)锌$\stackrel{稀硫酸}{→}$ 氢气$\stackrel{氧化铜}{→}$ 铜
(2)氧化铜$\stackrel{稀硫酸}{→}$ 硫酸铜 $\stackrel{锌铜}{→}$
若用这两种方法制得相同质量的铜时,下列叙述符合实际实验结果的是( )
(1)锌$\stackrel{稀硫酸}{→}$ 氢气$\stackrel{氧化铜}{→}$ 铜
(2)氧化铜$\stackrel{稀硫酸}{→}$ 硫酸铜 $\stackrel{锌铜}{→}$
若用这两种方法制得相同质量的铜时,下列叙述符合实际实验结果的是( )
| A. | 消耗相同质量的硫酸 | B. | 消耗相同质量的锌 | ||
| C. | 消耗相同质量的氧化铜 | D. | 生成的硫酸锌质量相同 |
19.下列反应不能通过一步反应实现的是( )
| A. | Fe→FeCl3 | B. | SiO2→Na2SiO3 | C. | Al2O3→Al(OH)3 | D. | NaO→Na2SO4 |
20.有短周期X、Y、Z、M、W为五种短周期元素.其中X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76g/L-1;W的质子数是X、Y、Z、M四种元素质子数之和的一半.下列说法正确的是( )
| A. | 原素Z、W的简单离子的电子层结构不同 | |
| B. | Y的最高价氧化物的水化物能与其简单气态氢化物反应生成盐且显碱性 | |
| C. | 由X元素形成的单质不一定是原子晶体 | |
| D. | 由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键 |
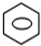 +HNO3(浓)$→_{50-60℃}^{浓H_{2}SO_{4}}$
+HNO3(浓)$→_{50-60℃}^{浓H_{2}SO_{4}}$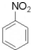 +H2O.
+H2O.