题目内容
14.已知如下化学反应.4HCl+O2$\frac{\underline{\;CuO/CuCl\;}}{400℃}$2Cl2+2H2O.完成下列填空:(1)该反应平衡常数的表达式K=$\frac{{c}^{2}(C{l}_{2})×{c}^{2}({H}_{2}O)}{{c}^{4}(HCl)×c({O}_{2})}$;若反应容器的容积为4L,4min后达到平衡,测得容器内物质由2.0mol减少至1.75mol,则HCl的平均反应速率为0.0625mol/(L?min).
(2)若该反应在体积不变的密闭容器中发生,当反应达平衡时,下列叙述正确的是c.
a.v (HCl)=2v(Cl2)
b.4v正(HCl)=v逆(O2)
c.又加入1molO2,达新平衡时,HCl的转化率增大
d.分离出H2O,达新平衡时,v正(HCl)增大.
分析 (1)化学平衡常数是指:一定温度下,可逆反应到达平衡时,生成物的浓度系数次幂之积与反应物的浓度系数次幂之积的比,固体、纯液体不需要在化学平衡常数中写出;
利用差量法计算消耗HCl物质的量,再根据v=$\frac{△c}{△t}$计算v(HCl);
(2)a.未指明正逆速率,不能确定是否到达平衡;
b.不同物质表示正逆速率之比等于化学计量数之比,反应到达平衡;
c.增大没有反应物难度,平衡正向氧气,其它反应物转化率增大;
d.分离出H2O,平衡正向移动,正反应速率减小至平衡状态.
解答 解:(1)4HCl+O2$\frac{\underline{\;CuO/CuCl\;}}{400℃}$2Cl2+2H2O的平衡常数表达式K=$\frac{{c}^{2}(C{l}_{2})×{c}^{2}({H}_{2}O)}{{c}^{4}(HCl)×c({O}_{2})}$;
4min后达到平衡,测得容器内物质由2.0mol减少至1.75mol,则:
4HCl+O2$\frac{\underline{\;CuO/CuCl\;}}{400℃}$2Cl2+2H2O 物质的量减小
4 1
1mol 2mol-1.75mol=0.25mol
故v=$\frac{\frac{1mol}{4L}}{4min}$=0.0625mol/(L?min),
故答案为:$\frac{{c}^{2}(C{l}_{2})×{c}^{2}({H}_{2}O)}{{c}^{4}(HCl)×c({O}_{2})}$;0.0625mol/(L?min);
(2)a.未指明正逆速率,不能确定是否到达平衡,若分别表示正逆速率,则处于平衡状态,故a错误;
b.4v正(HCl)=v逆(O2)均表示逆反应速率,反应始终按该比例关系进行,故b错误;
c.又加入1molO2,氧气浓度增大,平衡正向移动,HCl的转化率增大,故c正确;
d.分离出H2O,平衡正向移动,正反应速率减小至平衡状态,达新平衡时,v正(HCl)减小,故d错误,
故选:c.
点评 本题考查化学平衡计算与影响因素、平衡常数、反应速率计算、平衡状态判断等,注意判断平衡的物理量应随反应进行发生变化,该物理量由变化到不变化说明到达平衡.

 高效智能课时作业系列答案
高效智能课时作业系列答案| A. | 2H++2e-═H2↑ | B. | 2H2O+O2+4e-═4OH- | ||
| C. | Fe-3e═Fe3+ | D. | Fe-2e═Fe2+ |
| A. | 1 mol金属钠含有的电子数 | |
| B. | 1 L 1 mol/L硫酸溶液所含的H+数 | |
| C. | 标准状况下,22.4 L四氯化碳所含的分子数 | |
| D. | 0.012 kg 12C所含的原子数 |
| 温度/℃ | 0 | 100 | 200 | 300 | 400 |
| 平衡常数 | 667 | 13 | 1.9×10-2 | 2.4×10-4 | 1×10-5 |
| A. | 该反应的△H>0 | |
| B. | 加压、增大H2浓度和加入催化剂都能提高CO的转化率 | |
| C. | 工业上采用5×103kPa和 250℃的条件,其原因是原料气的转化率高 | |
| D. | t℃时,向 1 L密闭容器中投入0.1 mol CO和0.2 mol H2,平衡时CO转化率为50%,则该温度时反应的平衡常数的数值为100 |
| 元素代号 | X | Y | Z | Q | R | T |
| 原子半径/10-10m | 0.77 | 0.74 | 0.75 | 1.17 | 0.99 | 1.10 |
| 主要化合价 | +4、-4 | -2 | +5、-3 | +4、-4 | +7、-1 | +5、-3 |
| A. | X与Y可以形成阴离子XY32- | |
| B. | Z的氢化物的沸点比T的氢化物的沸点高 | |
| C. | 元素R的氧化物对应的水化物一定为强酸 | |
| D. | 由X形成的化合物XY2和XR4,其中XR4的沸点高 |
(1)CO可用于炼铁,已知:Fe2O3(s)+3C(s)═2Fe(s)+3CO(g)△H1=+489.0kJ•mol-1,C(s)+CO2(g)═2CO(g)△H2=+172.5kJ•mol-1.则CO还原Fe2O3(s)的热化学方程式为Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H=-28.5kJmol-1.
(2)CO2和H2充入一定体积的密闭容器中,在两种温度下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g) 测得CH3OH的物质的量随时间的变化见图.

①曲线Ⅰ、Ⅱ对应的平衡常数大小关系为KⅠ>KⅡ(填“>”或“=”或“<”).
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡.
| 容 器 | 甲 | 乙 |
| 反应物投入量 | 1molCO2、3molH2 | a molCO2、b molH2、 c molCH3OH(g)、c molH2O(g) |
③一定温度下,此反应在恒压容器中进行,能判断该反应达到化学平衡状态的依据是bd.
a.容器中压强不变 b.H2的体积分数不变 c.c(H2)=3c(CH3OH)
d.容器中密度不变 e.2个C=O断裂的同时有6个H-H断裂.
 | ⅠA | ⅡA | ⅢA | ⅠVA | VA | VⅠA | VⅡA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ |
(2)画出原子的结构示意图:④
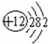 ,⑧
,⑧ ;
;(3)在表中有编号的元素中,金属性最强的元素是K,非金属性最强的元素是F,用电子式表示它们形成化合物的过程
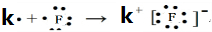 .最不活泼的元素是Ar.(以上均填元素名称)
.最不活泼的元素是Ar.(以上均填元素名称)(4)元素③、⑩、的氢氧化物碱性由强到弱的顺序KOH>NaOH;元素⑥、⑦、⑧的氢化物稳定性由弱到强的顺序SiH4<H2S<HCl(均用化学式填空)
(5)周期中有一种元素,其最高价氧化物的水化物与同周期其它元素最高价氧化物的水化物所属物质类型都不同,用离子方程式表示该水化物分别与烧碱溶液和稀硫酸的反应:Al(OH)3+OH-=AlO2-+2H2O、Al(OH)3+3H+=Al3++3H2O;.
(6)与①和⑥都相邻的一种元素A,它有多种不同形态的单质,其中一种常用作原电池的电极,它与⑦的最高价氧化物的水化物浓溶液在加热时能反应,写出化学反应方程式:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O
(7)写出能验证⑦的非金属性强于A的化学反应的离子方程式:CO32-+2H+=CO2↑+H2O.