题目内容
取100mL某盐酸和硝酸的混合溶液中,加入150mL 2mol?L-1的NaOH溶液,正好完全中和,然后再取100mL原盐酸和硝酸的混合液,加入足量AgNO3溶液,得沉淀14.35g.求:
(1)原混合溶液中H+的物质的量浓度;
(2)原混合溶液中所含HNO3的质量为多少?
(1)原混合溶液中H+的物质的量浓度;
(2)原混合溶液中所含HNO3的质量为多少?
考点:物质的量浓度的相关计算,溶液中溶质的质量分数及相关计算
专题:计算题
分析:(1)酸与氢氧化钠恰好反应,H+与OH-按物质的量之比1:1反应,故n(HNO3)+n(HCl)=n(NaOH),据此结合C=
原混合溶液中H+的物质的量浓度;
(2)然后再取100mL原盐酸和硝酸的混合液,加入足量AgNO3溶液,得沉淀14.35g,根据氯原子守恒,n(HCl)=n(AgCl),结合n(HNO3)+n(HCl)=n(NaOH),求出n(HNO3),再根据m=n×M求解.
| n |
| v |
(2)然后再取100mL原盐酸和硝酸的混合液,加入足量AgNO3溶液,得沉淀14.35g,根据氯原子守恒,n(HCl)=n(AgCl),结合n(HNO3)+n(HCl)=n(NaOH),求出n(HNO3),再根据m=n×M求解.
解答:
解:(1)150mL 2mol?L-1的NaOH溶液,n(NaOH)=C×V=150mL×2mol?L-1=0.3mol,正好完全中和,
酸与氢氧化钠恰好反应,H+与OH-按物质的量之比1:1反应,n(H+)=n(OH-)=n(NaOH)=0.3mol,c=
=
=3mol/L,
答:原混合溶液中H+的物质的量浓度为3mol/L;
(2)然后再取100mL原盐酸和硝酸的混合液,加入足量AgNO3溶液,得沉淀14.35g,Cl-+Ag+═AgCl↓,
n(AgCl)=
=
=0.1mol,n(HCl)=n(AgCl)=n(Cl-)=0.1mol,由(1)知n(HNO3)+n(HCl)=n(NaOH)=0.3mol,所以n(HNO3)=0.3mol-0.1mol=0.2mol,
则原混合溶液中所含HNO3的质量为m=n×M=0.2mol×63g/mol=12.6g,
答:原混合溶液中所含HNO3的质量为12.6g.
酸与氢氧化钠恰好反应,H+与OH-按物质的量之比1:1反应,n(H+)=n(OH-)=n(NaOH)=0.3mol,c=
| n |
| v |
| 0.3mol |
| 0.1L |
答:原混合溶液中H+的物质的量浓度为3mol/L;
(2)然后再取100mL原盐酸和硝酸的混合液,加入足量AgNO3溶液,得沉淀14.35g,Cl-+Ag+═AgCl↓,
n(AgCl)=
| m |
| M |
| 14.35g |
| 143.5g/mol |
则原混合溶液中所含HNO3的质量为m=n×M=0.2mol×63g/mol=12.6g,
答:原混合溶液中所含HNO3的质量为12.6g.
点评:本题考查混合物的有关计算,题目难度不大,注意根据氯原子守恒以及正好完全中和的含义进行解答.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
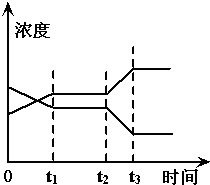 现有反应X(g)+Y(g)?2Z(g),△H>0.右图表示从反应开始到t1s时达到平衡,在t2s时由于条件变化使平衡破坏,到t3 s时又达平衡.则在图中t2 s时改变的条件可能是( )
现有反应X(g)+Y(g)?2Z(g),△H>0.右图表示从反应开始到t1s时达到平衡,在t2s时由于条件变化使平衡破坏,到t3 s时又达平衡.则在图中t2 s时改变的条件可能是( )| A、增大压强 |
| B、使用了催化剂 |
| C、升高温度 |
| D、减小了X或Y的浓度 |
由CaCO3和MgCO3组的混和物充分加热至质量不再减少时,称得残留的固体质量是原混和物的一半,则残留物中钙、镁两元素原子的物质的量之比( )
| A、1:1 | B、1:2 |
| C、1:3 | D、2:1 |
在周期表主族元素中,甲元素与乙、丙、丁三元素紧密相邻.甲、乙的原子序数之和等于丙的原子序数;这四种元素原子的最外层电子数之和为20.下列判断正确的是( )
| A、原子半径:丙>乙>甲>丁 |
| B、乙和甲或乙和丁所能形成的化合物都是大气污染物 |
| C、气态氢化物的稳定性:甲>丙 |
| D、最高价氧化物对应水化物的酸性:丁>甲 |
下列有关说法正确的是( )
| A、煮沸饱和的FeCl3溶液能得到红褐色的氯化铁胶体 |
| B、根据化合物在水溶液或熔融状态下是否导电,将化合物分为电解质和非电解质 |
| C、能与碱反应生成盐和水的化合物称为酸性氧化物 |
| D、溶液与胶体的本质区别是能否发生丁达尔现象 |
关于H2O2说法正确的是(NA代表阿伏加德罗常数)( )
| A、摩尔质量为34 g/mol |
| B、每个H2O2分子含2NA个氧原子 |
| C、2 mol H2O2含2 g氢元素 |
| D、H2O2分子中H、O原子个数比为1:16 |
设NA表示阿伏加德罗常数,下列说法正确的是( )
| A、1 mol NaHSO4晶体中离子总数为3NA |
| B、2.24 L 14CH4分子中所含中子数为0.8NA |
| C、0.1 L 3 mol?L-1的NH4NO3溶液中含有的NH4+数目为0.3NA |
| D、常温常压下,16gO2和O3混合气体含有NA个氧原子 |
Se是人体必需微量元素,下列关于
Se和
Se说法正确的是( )
78 34 |
80 34 |
A、
| ||||
B、
| ||||
C、
| ||||
D、
|
物质的量为0.10mol的镁条在只含有CO2和O2混合气体的容器中燃烧(产物不含碳酸镁),反应后容器内固体物质的质量不可能为( )
| A、3.2 g |
| B、4.0 g |
| C、4.2 g |
| D、4.6 g |