题目内容
已知A、B、C、D、E、F都是前四周期的元素,它们的核电荷数依次递增.其中B、C是同周期,A和C同主族,A最外层电子数为内层电子数的3倍,B的二价阳离子与A的二价阴离子电子层结构相同,D是前四周期未成对电子数最多的元素,E位于C的下一周期且价电子层中未成对电子数为4,F与E是同族元素,原子序数差1.
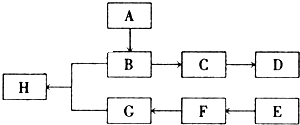
(1)C的原子结构示意图 ,E元素位于周期表的 区,F元素位于周期表的 族.
(2)比较B及其同周期与B相邻元素的氯化物的熔点由高到低的顺序(用化学式表示): ,原因是: .
(3)C的氢化物的分子VSEPR模型是 形,属于 分子.(填“极性”或“非极性”)
(4)F(Ⅲ)的八面体配合物FClm?nNH3,若1mol配合物与AgNO3作用生成1mol AgCl沉淀,则m、n的值分别为:m= ,n= .
(5)E原子半径为apm,1mol晶胞中含有 个原子,晶体密度为 g/cm3(只要求列算式,不必计算出数值,阿伏加德罗常数为NA).
(1)C的原子结构示意图
(2)比较B及其同周期与B相邻元素的氯化物的熔点由高到低的顺序(用化学式表示):
(3)C的氢化物的分子VSEPR模型是
(4)F(Ⅲ)的八面体配合物FClm?nNH3,若1mol配合物与AgNO3作用生成1mol AgCl沉淀,则m、n的值分别为:m=
(5)E原子半径为apm,1mol晶胞中含有
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:A、B、C、D、E、F都是前四周期的元素,它们的核电荷数依次递增.A最外层电子数为内层电子数的3倍,则A为O;其中B、C是同周期,A和C同主族,则C为S,B为第三周期元素;B的二价阳离子与A的二价阴离子电子层结构相同,则B为Mg;D是前四周期未成对电子数最多的元素,价电子为3d54s1,即D为Cr;E位于C的下一周期且价电子层中未成对电子数为4,价电子为3d64s2,即E为Fe;F与E是同族元素,原子序数差1,F为27号元素,为Co元素,以此来解答.
解答:
解:A、B、C、D、E、F都是前四周期的元素,它们的核电荷数依次递增.A最外层电子数为内层电子数的3倍,则A为O;其中B、C是同周期,A和C同主族,则C为S,B为第三周期元素;B的二价阳离子与A的二价阴离子电子层结构相同,则B为Mg;D是前四周期未成对电子数最多的元素,价电子为3d54s1,即D为Cr;E位于C的下一周期且价电子层中未成对电子数为4,价电子为3d64s2,即E为Fe;F与E是同族元素,原子序数差1,F为27号元素,为Co元素,
(1)C为S,原子结构示意图为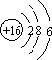 ,E为Fe,最后填充d电子,为d区元素;F位于第ⅤⅢ族,故答案为:
,E为Fe,最后填充d电子,为d区元素;F位于第ⅤⅢ族,故答案为: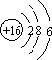 ;d;第ⅤⅢ;
;d;第ⅤⅢ;
(2)B及其同周期与B相邻元素的氯化物分别为NaCl、MgCl2、AlCl3,前二者为离子晶体,离子晶体中电荷大、离子半径小,则熔点高,氯化铝为分子晶体,则熔点由高到低的顺序MgCl2>NaCl>AlCl3,故答案为:MgCl2>NaCl>AlCl3;前二者为离子晶体,离子晶体中电荷大、离子半径小,则熔点高,氯化铝为分子晶体;
(3)C的氢化物为H2S,孤电子对数为2,成键数为2,分子VSEPR模型是四面体形,属于极性分子,故答案为:四面体;极性;
(4)F(Ⅲ)的八面体配合物FClm?nNH3,八面体的配位数为6,若1mol配合物与AgNO3作用生成1mol AgCl沉淀,则外界氯离子为1,Co为+3价,即化合物为[CoCl2.4NH3]Cl,所以m=3,n=4,故答案为:3;4;
(5)E为Fe,为体心立方结构,原子半径为apm,体对角线为4apm,晶胞棱长为x,则2x2=(4a)2,晶胞棱长为2
apm,1mol晶胞中含有1mol×(1+
×8)×NA=2NA个原子,晶体密度为
g/cm3,故答案为:2NA;
.
(1)C为S,原子结构示意图为
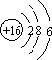 ,E为Fe,最后填充d电子,为d区元素;F位于第ⅤⅢ族,故答案为:
,E为Fe,最后填充d电子,为d区元素;F位于第ⅤⅢ族,故答案为: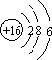 ;d;第ⅤⅢ;
;d;第ⅤⅢ;(2)B及其同周期与B相邻元素的氯化物分别为NaCl、MgCl2、AlCl3,前二者为离子晶体,离子晶体中电荷大、离子半径小,则熔点高,氯化铝为分子晶体,则熔点由高到低的顺序MgCl2>NaCl>AlCl3,故答案为:MgCl2>NaCl>AlCl3;前二者为离子晶体,离子晶体中电荷大、离子半径小,则熔点高,氯化铝为分子晶体;
(3)C的氢化物为H2S,孤电子对数为2,成键数为2,分子VSEPR模型是四面体形,属于极性分子,故答案为:四面体;极性;
(4)F(Ⅲ)的八面体配合物FClm?nNH3,八面体的配位数为6,若1mol配合物与AgNO3作用生成1mol AgCl沉淀,则外界氯离子为1,Co为+3价,即化合物为[CoCl2.4NH3]Cl,所以m=3,n=4,故答案为:3;4;
(5)E为Fe,为体心立方结构,原子半径为apm,体对角线为4apm,晶胞棱长为x,则2x2=(4a)2,晶胞棱长为2
| 2 |
| 1 |
| 8 |
| ||
(2
|
| ||
(2
|
点评:本题考查位置、结构、性质的关系及应用,为高频考点,把握电子排布、原子结构推断元素为解答的关键,侧重物质结构与性质及分析与推断能力的考查,题目难度较大.

练习册系列答案
相关题目