题目内容
与Li<Na<K<Rb<Cs的变化规律不符合的是( )
| A、与水或酸反应置换氢气的难易 |
| B、金属性的强弱 |
| C、熔点 |
| D、电子层数 |
考点:碱金属的性质,同一主族内元素性质递变规律与原子结构的关系
专题:
分析:根据元素周期律中同一主族元素的性质分析判断,同一主族元素,随着原子序数的增大,金属的金属性逐渐增强,原子半径逐渐增大,据此分析解答.
解答:
解:A、碱金属元素中,随着原子序数的增大,金属的金属性逐渐增强,失电子能力逐渐增强,所以与水或酸反应置换氢气逐渐容易,故A正确;
B、碱金属元素中,随着原子序数的增大,金属的金属性逐渐增强,故B正确;
C、碱金属元素中,随着原子序数的增大,金属的熔沸点逐渐降低,但K的熔点大于Na的熔点,故C错误;
D、碱金属元素中,随着原子序数的增大,电子层数以此增大,故D正确;
故选C.
B、碱金属元素中,随着原子序数的增大,金属的金属性逐渐增强,故B正确;
C、碱金属元素中,随着原子序数的增大,金属的熔沸点逐渐降低,但K的熔点大于Na的熔点,故C错误;
D、碱金属元素中,随着原子序数的增大,电子层数以此增大,故D正确;
故选C.
点评:本题以元素周期律为载体考查了碱金属元素性质的递变规律,难度不大,注意碱金属中密度的变化.

练习册系列答案
相关题目
某工厂的废渣中混有少量的锌粉和氧化铜(其它成分不跟酸反应),跟废盐酸接触形成污水.若向该污水中撒入铁粉,反应后铁粉有剩余,所得溶液中一定含有的金属离子是( )
| A、Fe2+、Cu2+ |
| B、Cu2+、Zn2+ |
| C、Zn2+、Fe2+ |
| D、Zn2+、Fe3+ |
下列说法或表示方法正确的是( )
| A、等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 |
| B、由C(石墨)→C(金刚石)△H=+1.9 KJ/mol可知,金刚石比石墨稳定 |
| C、1mol H2在足量Cl2中燃烧放热183KJ,则H2的燃烧热为183KJ |
| D、在稀溶液中,H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,整个过程放出的热量大于57.3 kJ |
下列有机化合物中的所有碳原子能处于同一平面上的是( )
| A、CH3CH2CH2CH2CH2CH3 |
B、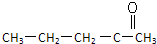 |
| C、CH2═CH-CH═CH2 |
| D、(CH3)3C-C≡C-CH=CHCH3CH2 |
环境污染问题越来越受到人们的关注,造成环境污染的主要原因大多是由于人类生产活动中过度排放有关物质引起的.下列环境问题与所对应的物质不相关的是( )
| A、温室效应--二氧化碳 |
| B、光化学污染--二氧化氮 |
| C、酸雨--二氧化碳 |
| D、臭氧层破坏--氟氯烃 |
室温下,水的电离达到平衡:H2O═H++OH-.加入下列物质能促进水的电离的是( )
| A、浓盐酸 | B、浓氨水 |
| C、金属钾 | D、饱和食盐水 |
把铜粉放入装有浓氨水的试管中,塞紧试管塞,振荡后发现试管塞越来越紧,且溶液逐渐变为浅黄色(近乎无色)溶液,打开试管塞后,溶液迅速变为蓝色溶液.则下列说法不正确的是( )
| A、试管塞越来越紧,是因为反应消耗了大量O2 |
| B、打开试管塞前Cu元素的化合价为+1价 |
| C、溶液迅速变为蓝色溶液,是因为反应生成了[Cu(H2O)4]2+ |
| D、上述反应原理可用于测定O2的含量 |