题目内容
12.某同学用氯气消毒的自来水配制下列溶液,不会引起药品明显变质的是( )| A. | KOH | B. | AgNO3 | C. | MgCl2 | D. | Ca(OH)2 |
分析 水中含有H+、Cl2、HClO、ClO-、Cl-等微粒,根据Ag+与Cl-反应,H+与弱酸根离子、氢氧根离子反应,亚铁离子具有还原性,能被氧化来解答.
解答 解:氯气部分溶于水,Cl2+H2O=HCl+HClO,所以溶液中存在氯气、盐酸、次氯酸等,与氯水中的物质不发生反应,
A、因氯水中含有H+,H+能与氢氧化钠反应生成水和氯化钠,则产生明显的药品变质问题,故A错误;
B、AgNO3与盐酸反应生成难溶的氯化银,而变质,故B不选;
C、与氯化镁不反应,不变质,故C选;
D、因氯水中含有H+,H+能与Ca(OH)2反应生成水和氯化钙,则产生明显的药品变质问题,故D不选;
故选:C.
点评 本题考查溶液的配制,明确氯水中的成分及离子之间的反应是解答本题的关键,难度不大.

练习册系列答案
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案
相关题目
3.NA表示阿伏伽德罗常数的值,下列叙述正确的是( )
| A. | 0.1mol NaHCO3晶体中含有NA个CO32- | |
| B. | 标准状况下,11.2L的18O2中所含的中子数为8NA | |
| C. | 1mol Fe与足量的稀HNO3反应,转移电子数目为3NA | |
| D. | 标准状况下,22.4L苯中含有碳氢键数目为6NA |
20.下列变化属于物理变化的是( )
| A. | 石油的裂解 | B. | 煤的干馏 | C. | 石油的裂化 | D. | 石油的分馏 |
7.下列说法正确的是( )
| A. | 氢键、分子间作用力、离子键、共价键都是微粒间的作用力,其中氢键、离子键和共价键是化学键 | |
| B. | 石墨烯是一种从石墨材料中用“撕裂”方法剥离出的单层碳原子面材料,用这种方法从C60、金刚石等中获得“只有一层碳原子厚的碳薄片”也必将成为研究方向 | |
| C. | 下列物质的熔沸点由大到小排列:晶体硅>碳化硅>金刚石 | |
| D. | 黄色晶体碳化铝,熔点2200℃,熔融态不导电,是原子晶体 |
17.下列实验操作中,错误的是( )
| A. | 分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| B. | 蒸馏时,应使温度计水银球位于蒸馏烧瓶支管处 | |
| C. | 萃取时,应选择有机萃取剂,且萃取剂的密度必须比水大 | |
| D. | 蒸发时,蒸发皿中出现大量固体时即停止加热 |
4.在乙醇的化学性质中,各反应的断键方式不正确的是( )
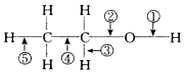

| A. | 与浓硫酸混合加热至170℃,断②⑤ | B. | 与氢卤酸反应断② | ||
| C. | 分子间脱水断①或② | D. | 与醋酸反应断② |
1.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | pH=1的溶液中:Fe2+、NO3-、SO42-、Na+ | |
| B. | 无色溶液中:K+、Fe3+、SO42-、H+ | |
| C. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1012 的溶液中:NH4+、Al3+、NO3-、Cl- | |
| D. | 由水电离的c (H+)=1×10一14 mol/L的溶液中:Ca2+、K+、Cl-、HCO3- |