题目内容
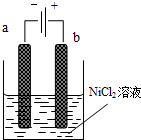 三氧化二镍(Ni2O3)可用于制造高能电池.一种制备Ni2O3的方法是电解NiCl2得Ni3+,再将Ni3+经一系列反应后转化为Ni2O3.其电解制备过程如下:用NaOH调NiCl2溶液pH至7.5,加放适量硫酸钠后进行电解.电解过程中产生的Cl2在弱碱性条件下生成ClO-,把二价镍氧化为三价镍.如图为电解装置示意图,电解池两极用阳离子交换膜隔开.请回答下列问题:
三氧化二镍(Ni2O3)可用于制造高能电池.一种制备Ni2O3的方法是电解NiCl2得Ni3+,再将Ni3+经一系列反应后转化为Ni2O3.其电解制备过程如下:用NaOH调NiCl2溶液pH至7.5,加放适量硫酸钠后进行电解.电解过程中产生的Cl2在弱碱性条件下生成ClO-,把二价镍氧化为三价镍.如图为电解装置示意图,电解池两极用阳离子交换膜隔开.请回答下列问题:(1)该电解池的阳极材料可选用
A.铁 B.Cu C.石墨 D.镍
(2)加放适量硫酸钠的作用是:
(3)电解过程中,阴极附近溶液的pH
(4)写出Ni2+转化为Ni3+的离子方程式:
(5)铁镍蓄电池又称爱迪生电池,放电时的总反应为:Fe+Ni2O3+3H2O
| 放电 |
| 充电 |
写出下列电极反应式:①放电时的正极:
(6)电池充电时,电池的负极应接外电源的
考点:电解原理,化学电源新型电池
专题:电化学专题
分析:(1)根据题意:制备Ni2O3的方法是电解NiCl2得Ni3+,在阳极上是Ni元素失电子的过程,据此判断阳极材料;
(2)硫酸钠是一种强电解质,溶液的导电能力强;
(3)根据电解池阴极上和阳极上的电极反应来判断;
(4)电解过程中产生的Cl2在弱碱性条件下生成ClO-,把二价镍氧化为三价镍,据此书写方程式;
(5)原电池的正极上发生得电子的还原反应,电解池的阴极上发生得电子的还原反应;
(6)原电池的负极发生氧化反应,电解池的阴极反应的逆反应是氧化反应,据此确定充电时,电极的连接情况.
(2)硫酸钠是一种强电解质,溶液的导电能力强;
(3)根据电解池阴极上和阳极上的电极反应来判断;
(4)电解过程中产生的Cl2在弱碱性条件下生成ClO-,把二价镍氧化为三价镍,据此书写方程式;
(5)原电池的正极上发生得电子的还原反应,电解池的阴极上发生得电子的还原反应;
(6)原电池的负极发生氧化反应,电解池的阴极反应的逆反应是氧化反应,据此确定充电时,电极的连接情况.
解答:
解:(1)根据题意:制备Ni2O3的方法是电解NiCl2得Ni3+,在阳极上是Ni元素失电子的过程,所以阳极材料是惰性电极材料,故答案为:C;
(2)硫酸钠是一种强电解质,向其中加入硫酸钠,是为了增加离子浓度,增强溶液的导电能力,故答案为:增加离子浓度,增强溶液的导电能力;
(3)电解过程中,阴极反应:2H++2e-=H2↑,该极附近溶液的pH升高,阳极反应:2Cl-2e-=Cl2↑,电解过程中阳极附近生成的氯气与水反应生成盐酸和次氯酸,溶液的pH降低,故答案为:升高;降低;
(4)电解过程中产生的Cl2在弱碱性条件下生成ClO-,把二价镍氧化为三价镍,即2Ni2++ClO-+H2O=2Ni3++Cl-+2OH-,故答案为:2Ni2++ClO-+H2O=2Ni3++Cl-+2OH-;
(5)①放电时,原电池的正极上发生得电子的还原反应Ni2O3+3H2O+2e-=2Ni(OH)2+2OH-,故答案为:Ni2O3+3H2O+2e-=2Ni(OH)2+2OH-;
②充电时,电解池的阴极反应的逆反应是氧化反应:Fe(OH)2+2e-=Fe+2 OH-,故答案为:Fe(OH)2+2e-=Fe+2 OH-;
(6)二次电池充电时,电池的负极和电源的负极相连,故答案为:负极.
(2)硫酸钠是一种强电解质,向其中加入硫酸钠,是为了增加离子浓度,增强溶液的导电能力,故答案为:增加离子浓度,增强溶液的导电能力;
(3)电解过程中,阴极反应:2H++2e-=H2↑,该极附近溶液的pH升高,阳极反应:2Cl-2e-=Cl2↑,电解过程中阳极附近生成的氯气与水反应生成盐酸和次氯酸,溶液的pH降低,故答案为:升高;降低;
(4)电解过程中产生的Cl2在弱碱性条件下生成ClO-,把二价镍氧化为三价镍,即2Ni2++ClO-+H2O=2Ni3++Cl-+2OH-,故答案为:2Ni2++ClO-+H2O=2Ni3++Cl-+2OH-;
(5)①放电时,原电池的正极上发生得电子的还原反应Ni2O3+3H2O+2e-=2Ni(OH)2+2OH-,故答案为:Ni2O3+3H2O+2e-=2Ni(OH)2+2OH-;
②充电时,电解池的阴极反应的逆反应是氧化反应:Fe(OH)2+2e-=Fe+2 OH-,故答案为:Fe(OH)2+2e-=Fe+2 OH-;
(6)二次电池充电时,电池的负极和电源的负极相连,故答案为:负极.
点评:本题涉及原电池和电解池的工作原理的应用,注意电极反应式的书写是解题的关键,难度不大.

练习册系列答案
相关题目
下列各组溶液,不用其他试剂,就能将组内物质鉴别出来的是( )
| A、NaCl HCl H2SO4 AgNO3 |
| B、CuSO4 NaOH BaCl2 HCl |
| C、KCl HCl NaOH BaCl2 |
| D、NaOH KOH MgCl2 H2SO4 |
广义的水解观认为,无论是盐的水解还是非盐的水解,其最终结果是反应中各物质和水分别解离成两部分,然后两两重新组合成新的物质,根据上述观点,下列说法不正确的是( )
| A、Na2O2的水解产物是NaOH和H2O2 |
| B、NaClO的水解产物之一是HClO |
| C、CCl4的水解产物是CH4和HClO |
| D、CaC2的水解生成C2H2和Ca(OH)2 |
现有CuO和Fe2O3的混合物a g,向其中加入1mol?L-1的HNO3溶液200mL恰好完全反应,若将2a g该混合物用足量CO还原,充分反应后剩余固体质量为( )
| A、(2a-1.6)g |
| B、2(a-1.6)g |
| C、(a-1.6)g |
| D、3.2 g |
某金属混合物1.5g,跟足量的稀硫酸反应,共产生560ml氢气(S.T.P),此混合物的组成可能是( )
| A、镁和铝 | B、钙和镁 |
| C、铝和锌 | D、铝和铁 |
 由于工业发展,燃烧设备不断增多,设备规模不断增大.这些工厂排放的烟气中都会有大量的SO2废气.据统计,我国1995年工业SO2的排放量为1396万吨,2006年工业SO2的排放量达到了3800万吨,由于SO2的污染,我国每年损失高达1100亿元.
由于工业发展,燃烧设备不断增多,设备规模不断增大.这些工厂排放的烟气中都会有大量的SO2废气.据统计,我国1995年工业SO2的排放量为1396万吨,2006年工业SO2的排放量达到了3800万吨,由于SO2的污染,我国每年损失高达1100亿元.