题目内容
在一定温度下将1mol CO和3mol水蒸气放在密闭的容器中发生下列反应:CO(g)+H2O(g)?CO2(g)+H2(g)达到平衡后,测得CO2为0.75mol,再通入6mol水蒸气,达到新的平衡后,CO2和H2的物质的量分别是多少?
考点:化学平衡的计算
专题:化学平衡专题
分析:反应CO+H2O(g)?CO2+H2达平衡后,结合平衡三段式列式计算平衡常数,加入水蒸气,化学平衡会向着正反应方向进行,平衡常数随温度变化,不随浓度变化,依据平衡三段式列式计算得到;
解答:
解:根据题意:CO+H2O(g)?CO2 +H2,
初始物质的量:1 3 0 0
变化物质的量:0.75 0.75 0.75 0.75
平衡物质的量:0.25 2.25 0.75 0.75
反应前后气体物质的量不变,可以利用物质的量代替平衡浓度计算
K=
=1
再通入6mol水蒸气,化学平衡会向着正反应方向进行,相当于起始量为1molCO,9molH2O,设消耗一氧化碳物质的量为x
根据题意:CO+H2O(g)?CO2 +H2,
初始物质的量:1 9 0 0
变化物质的量:x x x x
平衡物质的量:1-x 9-x x x
=1
x=0.9,则二氧化碳和氢气物质的量为0.9mol;
答:CO2和H2的物质的量是0.9mol;
初始物质的量:1 3 0 0
变化物质的量:0.75 0.75 0.75 0.75
平衡物质的量:0.25 2.25 0.75 0.75
反应前后气体物质的量不变,可以利用物质的量代替平衡浓度计算
K=
| 0.75×0.75 |
| 0.25×2.25 |
再通入6mol水蒸气,化学平衡会向着正反应方向进行,相当于起始量为1molCO,9molH2O,设消耗一氧化碳物质的量为x
根据题意:CO+H2O(g)?CO2 +H2,
初始物质的量:1 9 0 0
变化物质的量:x x x x
平衡物质的量:1-x 9-x x x
| x2 |
| (1-x)(9-x) |
x=0.9,则二氧化碳和氢气物质的量为0.9mol;
答:CO2和H2的物质的量是0.9mol;
点评:本题考查学生可逆反应的特征以及化学平衡移动方面的知识,注意化学平衡常数随温度变化,不随浓度变化,平衡三段式是解题的关键,难度不大.

练习册系列答案
相关题目
下列试剂可一次性鉴别BaCl2、NaOH、KI和苯酚四瓶无色水溶液的是( )
| A、NH4Cl |
| B、Na2SO4 |
| C、FeCl3 |
| D、稀H2S04 |
两种金属混合物19.6克,投入到一定量的盐酸中,反应完全后得到11.2L(标准状况)的氢气,此金属混合物不可能是( )
| A、Mg和Al |
| B、Al和Fe |
| C、Mg和Cu |
| D、Fe和Zn |
100℃时,两种气态烃以任意比混合,1L混合烃与9L O2混合,充分燃烧后恢复到原状态,所得气体体积仍为10L.下列各组混合烃不符合此条件的是( )
| A、CH4和C2H4 |
| B、CH4和C3H4 |
| C、C2H2和C3H6 |
| D、C2H4和C3H4 |
下列图片所示做法不能达到相应目的是( )
| A | B | C | D | |
| 做法 |  锡中加入一定量 的铅制成焊锡 |  聚乙烯制成薄膜 |  废荧光灯管放入有 此标志的垃圾桶 |  橡胶硫化 |
| 目的 | 降低熔点 | 用于食品、药品包装材料 | 防止重金属污染 | 增强橡胶的强度、韧性、弹性和化学稳定性 |
| A、A | B、B | C、C | D、D |
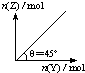 在一定温度和压强下,向盛有足量X的体积可变的密闭容器中通入Y气体,发生反应:X(s)+aY(g)?bZ(g)+W(g);△H>0平衡时Z的物质的量与通入Y的物质的量的变化关系如图所示.下列说法中正确的是( )
在一定温度和压强下,向盛有足量X的体积可变的密闭容器中通入Y气体,发生反应:X(s)+aY(g)?bZ(g)+W(g);△H>0平衡时Z的物质的量与通入Y的物质的量的变化关系如图所示.下列说法中正确的是( )A、平衡时Y的转化率为
| ||
| B、向容器中再加入少量X,则Y的转化率增大 | ||
| C、再通入Y,重新达到平衡时W的体积分数不变 | ||
| D、保持压强一定,当原反应在较高温度下建立平衡时,图中θ<45° |
下列说法正确的是( )
| A、将pH=5的硫酸溶液稀释500倍溶液中c(SO42-):c(H+)≈1:10 |
| B、常温下,将pH=5的醋酸溶液稀释100倍后溶液pH=7 |
| C、常温下,将pH=9的氢氧化钠溶液稀释100倍后溶液pH=7 |
| D、常温下,将0.01mol?L-1的硫酸溶液稀释100倍后溶液pH=4 |




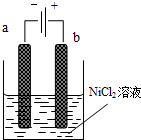 三氧化二镍(Ni2O3)可用于制造高能电池.一种制备Ni2O3的方法是电解NiCl2得Ni3+,再将Ni3+经一系列反应后转化为Ni2O3.其电解制备过程如下:用NaOH调NiCl2溶液pH至7.5,加放适量硫酸钠后进行电解.电解过程中产生的Cl2在弱碱性条件下生成ClO-,把二价镍氧化为三价镍.如图为电解装置示意图,电解池两极用阳离子交换膜隔开.请回答下列问题:
三氧化二镍(Ni2O3)可用于制造高能电池.一种制备Ni2O3的方法是电解NiCl2得Ni3+,再将Ni3+经一系列反应后转化为Ni2O3.其电解制备过程如下:用NaOH调NiCl2溶液pH至7.5,加放适量硫酸钠后进行电解.电解过程中产生的Cl2在弱碱性条件下生成ClO-,把二价镍氧化为三价镍.如图为电解装置示意图,电解池两极用阳离子交换膜隔开.请回答下列问题: