题目内容
某金属混合物1.5g,跟足量的稀硫酸反应,共产生560ml氢气(S.T.P),此混合物的组成可能是( )
| A、镁和铝 | B、钙和镁 |
| C、铝和锌 | D、铝和铁 |
考点:有关混合物反应的计算
专题:计算题
分析:假设该混合物中金属都为+2价,计算求出平均相对原子质量,若金属不反应,根据电子转移守恒,可以视作其相对原子质量为无穷大,然后分析给定选项.
解答:
解:标况下,氢气物质的量为
=0.025mol,假设该混合物中金属都为+2价,由电子转移守恒可知金属的物质的量为0.025mol,则金属平均相对分子质量为
=60,
A.Mg相对分子质量为24,Al为+2价,相对分子质量为27×
=18,平均相对分子质量介于18~24之间,不符合,故A错误;
B.钙、镁相对分子质量分别为40、24,均小于60,故B错误;
C.Al为+2价,相对分子质量为27×
=18,Zn相对分子质量为65,60介于18~65之间,故C正确;
D.Al为+2价,相对分子质量为27×
=18,Fe相对分子质量为56,均小于60,故D错误,
故选C.
| 0.56L |
| 22.4L/mol |
| 1.5 |
| 0.025 |
A.Mg相对分子质量为24,Al为+2价,相对分子质量为27×
| 2 |
| 3 |
B.钙、镁相对分子质量分别为40、24,均小于60,故B错误;
C.Al为+2价,相对分子质量为27×
| 2 |
| 3 |
D.Al为+2价,相对分子质量为27×
| 2 |
| 3 |
故选C.
点评:本题考查混合物计算,难度中等,注意利用平均量进行解答,侧重对学生分析思维能力与解题方法技巧的考查.

练习册系列答案
相关题目
下列试剂中,能用于检验酒精中是否含有水的是( )
| A、无水硫酸铜 |
| B、CuSO4?5H2O |
| C、浓硫酸 |
| D、金属钠 |
提纯含有少量泥沙的粗盐,下列操作顺序正确的是( )
| A、过滤、蒸发、结晶、溶解 |
| B、溶解、蒸发、过滤、结晶 |
| C、溶解、蒸发、结晶、过滤 |
| D、溶解、过滤、蒸发、结晶 |
下列图片所示做法不能达到相应目的是( )
| A | B | C | D | |
| 做法 |  锡中加入一定量 的铅制成焊锡 |  聚乙烯制成薄膜 |  废荧光灯管放入有 此标志的垃圾桶 |  橡胶硫化 |
| 目的 | 降低熔点 | 用于食品、药品包装材料 | 防止重金属污染 | 增强橡胶的强度、韧性、弹性和化学稳定性 |
| A、A | B、B | C、C | D、D |
某不纯的烧碱样品中各成分的质量分数如下表所示:
取a g样品溶于50mL2mol/L的盐酸中,充分反应后,再用适量2mol/LNaOH溶液将剩余的酸恰好中和,最后将溶液蒸干,可得干燥固体的质量为( )
| 成分 | NaOH | Na2CO3 | H2O |
| 质量分数 | 90.4% | 3.8% | 5.8% |
| A、4.68 g |
| B、5.85 g |
| C、2.34 g |
| D、(2.34-a) g |
当航天飞机返回地球大气层时,由于空气的剧烈摩擦,飞机尖端的温度可达1000℃以上,为了防止高温将它烧毁,科学家给航天飞机的相应部位安装了可靠的保护层.制作保护层的材料是( )
| A、塑料 |
| B、合成纤维 |
| C、新型陶瓷和碳纤维的复合材料 |
| D、镁铝合金 |
 工业上研究燃料脱硫的过程中,涉及如下反应:
工业上研究燃料脱硫的过程中,涉及如下反应: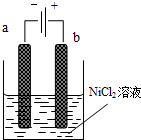 三氧化二镍(Ni2O3)可用于制造高能电池.一种制备Ni2O3的方法是电解NiCl2得Ni3+,再将Ni3+经一系列反应后转化为Ni2O3.其电解制备过程如下:用NaOH调NiCl2溶液pH至7.5,加放适量硫酸钠后进行电解.电解过程中产生的Cl2在弱碱性条件下生成ClO-,把二价镍氧化为三价镍.如图为电解装置示意图,电解池两极用阳离子交换膜隔开.请回答下列问题:
三氧化二镍(Ni2O3)可用于制造高能电池.一种制备Ni2O3的方法是电解NiCl2得Ni3+,再将Ni3+经一系列反应后转化为Ni2O3.其电解制备过程如下:用NaOH调NiCl2溶液pH至7.5,加放适量硫酸钠后进行电解.电解过程中产生的Cl2在弱碱性条件下生成ClO-,把二价镍氧化为三价镍.如图为电解装置示意图,电解池两极用阳离子交换膜隔开.请回答下列问题: 在密闭容器中有A、B两种物质,在一定的条件下反应:2A(气)+B(固)?2C(气)△H>0达到平衡后,改变一个条件(X),下列量(Y)一定符合图中曲线的是( )
在密闭容器中有A、B两种物质,在一定的条件下反应:2A(气)+B(固)?2C(气)△H>0达到平衡后,改变一个条件(X),下列量(Y)一定符合图中曲线的是( )