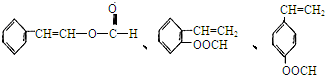题目内容
短周期元素X、Y、Z、W、Q在周期表中的位置如图所示,下列说法正确的是( )


A、
| ||||
| B、形成简单离子的半径从小到大的顺序是W+<Q3+<Z3- | ||||
| C、科学家建议将X与Y排在同一主族,是因为它们形成的化合物最多 | ||||
| D、Z的最高价氧化物对应水化物的酸性比R的最高价氧化物对应水化物的酸性强 |
考点:元素周期律和元素周期表的综合应用
专题:
分析:根据元素在周期表中位置知,X、Y、Z、W、Q、R分别是H、C、N、Na、Al、P元素,
A.质子数相等、中子数不等的原子互称同位素,同位素化学性质相同;
B.电子层数越多其离子半径越大,电子层结构结构相同的离子,其离子半径随着原子序数增大而减小;
C.科学家建议将X与Y排在同一主族,是因为它们的最低负化合价的绝对值与其族序数相等;
D.元素的非金属性越强,其最高价氧化物的水化物酸性越强.
A.质子数相等、中子数不等的原子互称同位素,同位素化学性质相同;
B.电子层数越多其离子半径越大,电子层结构结构相同的离子,其离子半径随着原子序数增大而减小;
C.科学家建议将X与Y排在同一主族,是因为它们的最低负化合价的绝对值与其族序数相等;
D.元素的非金属性越强,其最高价氧化物的水化物酸性越强.
解答:
解:根据元素在周期表中位置知,X、Y、Z、W、Q、R分别是H、C、N、Na、Al、P元素,
A.质子数相等、中子数不等的原子互称同位素,
X2与
X2不是原子是单质,所以不是同位素,但它们的化学性质相同物理量性质不同,故A错误;
B.电子层数越多其离子半径越大,电子层结构结构相同的离子,其离子半径随着原子序数增大而减小,Na+、Al3+、N3-的电子层结构相同,N、Na、Al元素原子序数依次增大,所以离子半径顺序是Al3+<Na+<N3-,故B错误;
C.科学家建议将X与Y排在同一主族,是因为它们的最低负化合价的绝对值与其族序数相等,所以与它们形成的化合物多少无关,故C错误;
D.Z是N元素、R是P元素,非金属性N>R,所以Z的最高价氧化物对应水化物的酸性比R的最高价氧化物对应水化物的酸性强,故D正确;
故选D.
A.质子数相等、中子数不等的原子互称同位素,
1 |
2 |
B.电子层数越多其离子半径越大,电子层结构结构相同的离子,其离子半径随着原子序数增大而减小,Na+、Al3+、N3-的电子层结构相同,N、Na、Al元素原子序数依次增大,所以离子半径顺序是Al3+<Na+<N3-,故B错误;
C.科学家建议将X与Y排在同一主族,是因为它们的最低负化合价的绝对值与其族序数相等,所以与它们形成的化合物多少无关,故C错误;
D.Z是N元素、R是P元素,非金属性N>R,所以Z的最高价氧化物对应水化物的酸性比R的最高价氧化物对应水化物的酸性强,故D正确;
故选D.
点评:本题考查元素周期表和元素周期律综合应用,明确原子结构、元素性质、元素周期律内涵即可解答,注意同位素物理性质不同其化学性质相同,为易错点.

练习册系列答案
相关题目
无色溶液中含有:①Na+、②Ba2+、③C1-、④Br-、⑤SO32-、⑥SO42-、⑦Fe2+离子中的一种或几种,依次进行下列实验,且每步所加试剂均过量,观察到的现象如下:根据上述实验现象,判断以下结论中正确的是( )
| 步骤 | 操作 | 现象 |
| ① | 用pH试纸检验 | 溶液的pH大于7 |
| ② | 向溶液中滴加氯水,再加入CC14振荡,静置 | CC14层呈橙红色 |
| ③ | 取②的上层溶液,加入Ba(NO3)2溶液和稀HNO3 | 有白色沉淀产生 |
| ④ | 将③过滤,向滤液中加入AgNO3溶液和稀HNO3 | 有白色沉淀产生 |
| A、肯定含有的离子是①④⑤ |
| B、肯定没有的离子是②⑤⑦ |
| C、可能含有的离子是①②⑥ |
| D、不能确定的离子是①③⑥ |
在氧化还原反应CuO+H2
Cu+H2O中,还原产物是( )
| ||
| A、CuO |
| B、H2 |
| C、Cu |
| D、H2O |
实验室里利用以下反应制取少量氮气:NaNO2+NH4Cl═NaCl+N2↑+2H2O.关于该反应的下列说法正确的是( )
| A、每生成1 mol N2转移的电子的物质的量为6 mol |
| B、N2既是氧化剂,又是还原剂 |
| C、NH4Cl中的氮元素被还原 |
| D、NaNO2是氧化剂 |
反应①是自海藻灰中提取碘的主要反应,反应②是自智利硝石中提取碘的主要反应:①2NaI+MnO2+3H2SO4=2NaHSO4+MnSO4+2H2O+I2;②2NaIO3+5NaHSO3=2Na2SO4+3NaHSO4+H2O+I2.已知NaIO3的氧化性与MnO2相近,下列有关说法正确的是( )
| A、两个反应中生成等量的I2时转移的电子数相等 |
| B、I2在反应①②中都是氧化产物 |
| C、NaI和NaIO3在一定条件下能反应生成I2 |
| D、NaIO3在任何化学反应中只能作氧化剂,不能作还原剂 |
设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A、1molCH4分子共价键总数为NA |
| B、含NA个Na+的Na2O2溶于1L水中,Na+的物质的量浓度为1mol/L |
| C、常温常压下,14g由N2与CO组成的混合气体含有的原子数目为NA |
| D、1molMg与足量O2或N2反应生成MgO或Mg3N2失去电子分别为2NA和3NA |
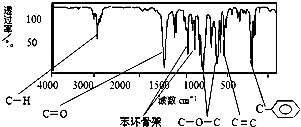 肉桂酸甲酯是调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精,用于肥皂、洗涤剂、风味剂和糕点的调味,在医药工业中作为有机合成的中间体.
肉桂酸甲酯是调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精,用于肥皂、洗涤剂、风味剂和糕点的调味,在医药工业中作为有机合成的中间体.