题目内容
13.实验室需要配制离子浓度均为1mol•L-1下列离子的溶液,你认为能配制成功的是( )| A. | Al3+、NO${\;}_{3}^{-}$、K+、SO${\;}_{4}^{2-}$ | B. | Cu2+、Ba2+、SO${\;}_{4}^{2-}$、CO${\;}_{3}^{2-}$ | ||
| C. | OH-、Cl-、NH${\;}_{4}^{+}$、Na+ | D. | Mg2+、Na+、SO${\;}_{4}^{2-}$、NO${\;}_{3}^{-}$ |
分析 A.浓度相等时不满足电荷守恒;
B.铜离子与碳酸根离子反应,钡离子与硫酸根离子、碳酸根离子反应;
C.氢氧根离子与铵根离子反应;
D.四种离子之间不反应,浓度相等时满足电荷守恒.
解答 解:A.该组离子之间不反应,可大量共存,但溶液中四种离子的浓度均为1mol•L-1,不满足电荷守恒,故A错误;
B.Ba2+与SO42-、CO32-反应,Cu2+、CO32-反应,在溶液中不能共存,无法配制该溶液,故B错误;
C.OH-、NH4+之间发生反应,在溶液中不能大量共存,无法配制该溶液,故C错误;
D.该组离子之间不反应,可大量共存,且溶液中四种离子的浓度均为1mol•L-1,满足电荷守恒,故D正确;
故选D.
点评 本题考查离子的共存的判断与应用,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,注意电荷守恒的应用方法,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案
相关题目
3.有机物结构理论中有一个重要的观点:有机物分子中原子间或原子团间可以产生相互影响,从而导致化学性质的不同,以下的事实不能说明此观点是( )
| A. | ClCH2COOH的酸性比CH3COOH酸性强 | |
| B. | 苯酚能与NaOH溶液反应而乙醇则很难 | |
| C. | HOOCCH2CHO既能发生银镜反应又能发生酯化反应 | |
| D. | 丙酮(CH3COCH3)中的氢原子比乙烷中的氢原子更易发生卤代反应 |
1.一定条件下,可逆反应X(g)+3Y(g)?2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0),平衡时X、Y、Z的浓度分别为0.1molL-1、0.3molL-1、0.08molL-1,则下列判断不合理的是( )
| A. | c1:c2=1:3 | B. | 平衡时,Y与Z的生成速率之比为3:2 | ||
| C. | X、Y的转化率不相等 | D. | c1的取值范围0<c1<0.14 molL-1 |
5.下列实验操作正确的是( )
| A. |  测溶液pH | B. |  过滤 | C. |  稀释浓硫酸 | D. |  检查气密性 检查气密性 |
 已知反应AsO43-+2I-+H+?AsO33-+I2+H2O是可逆反应.设计如图装置,进行下述操作:
已知反应AsO43-+2I-+H+?AsO33-+I2+H2O是可逆反应.设计如图装置,进行下述操作: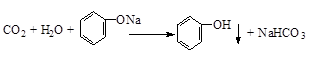 .
.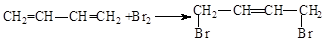 .
. .
.
 ,它可通过不同化学反应分别制得B、C、D和E四种物质
,它可通过不同化学反应分别制得B、C、D和E四种物质
 ;A→D:
;A→D: .
. .
.