题目内容
19.水是人类赖以生存不可缺少的物质,水质优劣直接影响人体健康(1)天然水在净化处理过程中常加入明矾作混凝剂,其净水作用的原理是Al3++3H2O?Al(OH)3(胶体)+3H+(用离子方程式表示).
(2)含有较多Ca2+、Mg2+的水称为硬水,家庭可以用肥皂水检验水的硬度,因为高级脂肪酸钠与硬水中的钙离子、镁离子形成硬脂酸钙、硬脂酸镁沉淀.经查阅资料可知,硬度为1°的水是指每升水含10mgCaO或与之相当的物质(如7.lmgMgO),已知水的硬度在8°以下的称为软水,在8°以上的称为硬水.现有某一品牌的山泉水中c(Ca2+)=1.2×l0-3 mol/L,c(Mg2+)=6×l0-4mol/L那么此水是(填“是”或“否”)属于硬水.
(3)人类把海水淡化,就可以得到大量的饮用水,常规蒸馏法,技术和工艺比较完备,但也存在较大缺陷,大量推广离子交换法和电渗析法.电渗析法淡化海水的示意图如图1所示,其中阴(阳)离子交换膜仅允许阴(阳)离子通过.阳极的主要电极反应式是2Cl--2e-=Cl2↑,在阴极附近加入无色酚酞,看到的现象是溶液变红,有无色气体放出,淡水的出口为b(填“a”“b”或“c”).

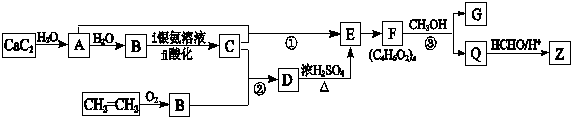
(4)海水资源的综合利用可获得一系列的化工产品,其中利用海水制得的食盐可制取纯碱,其简要流程如图2所示:
①完成操作1所需的玻璃仪器有漏斗、玻璃棒、烧杯.
②滤出晶体C后,从滤液D中提取氯化铵有两种方法:
方法一、通入氨气,冷却、加食盐,过滤;
方法二、不通氨气,冷却、加食盐,过滤.
对两种方法的评价正确的是ad(填序号)
a.方法一析出的氯化铵纯度更高 b.方法二析出的氯化铵纯度更高
c.方法一的滤液可直接循环使用 d.方法二的滤液可直接循环使用
③提取的NH4Cl中含有少量Fe2+、SO42-.将产品溶解,加入H2O2,加热至沸,再加入BaCl2溶液,过滤,蒸发结晶,得到工业氯化铵.加热至沸的目的是使Fe3+完全水解为Fe(OH)3,滤渣的主要成分是Fe(OH)3、BaSO4.
分析 (1)明矾可水解生成具有吸附性的胶体;
(2)硬水是含有较多可溶性钙盐、镁盐的水,肥皂中含有高级酯肪酸钠,能与钙离子生成沉淀,依据硬度为1°的水是指每升水含10mgCaO或与之相当的物质(如7.1mgMgO),将水中的Ca2+、Mg2+质量折算成CaO的质量计算得到;
(3)依据电渗析法淡化海水示意图分析,阴(阳)离子交换膜仅允许阴(阳)离子通过.所以阳极上是阴离子失电子发生氧化反应,海水中的氯离子失电子生成氯气;阴极是氢离子得到电子发生还原反应生成氢气,阴极附近氢氧根离子浓度增大;在电渗析法淡化海水示意图中阴离子移向阳极,阳离子移向阴极,所以水在b处流出;
(4)在氨气饱和的氯化钠溶液中通入二氧化碳,反应生成碳酸氢钠,过滤得到氯化铵溶液以及碳酸氢钠,加热碳酸氢钠得到碳酸钠,
①操作1为过滤,用于分离固体和液体;
②滤液D中含有碳酸氢钠和氯化铵,a.方法一通入氨,使溶液中的碳酸氢钠生成碳酸钠,再加食盐,过滤,析出的氯化铵纯度更高;
b.方法二没有通氨气,冷却、加食盐,过滤,析出的氯化铵中会有碳酸氢钠,纯度不高;
c.方法一的滤液含有碳酸钠不可直接循环使用;
d.方法二的滤液主要成分还是碳酸氢钠和氯化铵,还有氯化钠,可直接循环使用;
③提取的NH4Cl中含有少量Fe2+、SO42-.将产品溶解,加入H2O2,将亚铁离子氧化成铁离子,加热至沸,促使铁离子水解生成氢氧化铁沉淀,再加入BaCl2溶液,使硫酸根离子沉淀,过滤,蒸发结晶,得到工业氯化铵,据此答题.
解答 解:(1)然水在净化处理过程中加入明矾做混凝剂,因明矾水解生成具有吸附性的胶体,反应的离子方程式为Al3++3H2O?Al (OH)3(胶体)+3H+,
故答案为:Al3++3H2O?Al (OH)3(胶体)+3H+;
(2)硬水是含有较多可溶性钙盐、镁盐的水,肥皂中含有高级酯肪酸钠,能与硬水中的钙离子、镁离子形成硬脂酸钙、硬脂酸镁沉淀,
某天然水中c(Ca2+)=1.2×10-3mol•L-1,c(Mg2+)=6×10-4mol•L-1,硬度为1°的水是指每升水含10mgCaO或与之相当的物质(如7.1mgMgO);1L水中钙离子物质的量=1.2×10-3mol,相当于CaO质量=1.2×10-3mol×56g/mol=67.2mg,1L水中镁离子物质的量=6×10-4mol,相当于氧化镁质量6×10-4mol×40g/mol=24mg,水的硬度=$\frac{76.2mg}{10mg}$+$\frac{24mg}{7.1mg}$=10°,属于硬水;
故答案为:Ca2+、Mg2+;高级脂肪酸钠与硬水中的钙离子、镁离子形成硬脂酸钙、硬脂酸镁沉淀;是;
(3)依据电渗析法淡化海水示意图分析,阴(阳)离子交换膜仅允许阴(阳)离子通过,所以阳极上是阴离子失电子发生氧化反应,海水中的氯离子失电子生成氯气,电极反应为:2Cl--2e-=Cl2↑,阴极是氢离子得到电子发生还原反应生成氢气,阴极附近氢氧根离子浓度增大,在阴极附近加入无色酚酞,可以看到阴极附近溶液变红色,有无色气体放出;在电渗析法淡化海水示意图中阴离子移向阳极,阳离子移向阴极,所以水在b处流出,
故答案为:2Cl--2e-=Cl2↑;溶液变红,有无色气体放出; b;
(4)①操作1为过滤,所需的玻璃仪器有漏斗、玻璃棒、烧杯,故答案为:漏斗、玻璃棒、烧杯;
②滤液D中含有碳酸氢钠和氯化铵,a.方法一通入氨,使溶液中的碳酸氢钠生成碳酸钠,再加食盐,过滤,析出的氯化铵纯度更高,故a正确;
b.方法二没有通氨气,冷却、加食盐,过滤,析出的氯化铵中会有碳酸氢钠,纯度不高,故b错误;
c.方法一的滤液含有碳酸钠不可直接循环使用,故c错误;
d.方法二的滤液主要成分还是碳酸氢钠和氯化铵,还有氯化钠,可直接循环使用,故d正确;
故答案为:ad;
③提取的NH4Cl中含有少量Fe2+、SO42-.将产品溶解,加入H2O2,将亚铁离子氧化成铁离子,加热至沸,促使铁离子水解生成氢氧化铁沉淀,再加入BaCl2溶液,使硫酸根离子沉淀,过滤,蒸发结晶,得到工业氯化铵,所以滤渣的主要成分是,
故答案为:使Fe3+完全水解为Fe(OH)3;Fe(OH)3、BaSO4.
点评 本题以海水资源开发利用为载体综合考查物质的分离、提纯,为高考常见题型,侧重于学生的分析、实验能力的考查,题目涉及粗盐的提纯、水的净化、硬水的软化、电解食盐水等,是对知识的综合应用,难度中等.

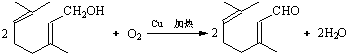
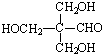
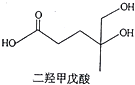 二羟甲戊酸是生物合成青蒿素的原料之一,下列关于二羟甲戊酸的说法正确的是( )
二羟甲戊酸是生物合成青蒿素的原料之一,下列关于二羟甲戊酸的说法正确的是( )| A. | 与乙醇发生酯化反应生成产物的分子式为C8H18O4 | |
| B. | 能发生加成反应,不能发生取代反应 | |
| C. | 在铜的催化下与氧气反应的产物可以发生银镜反应 | |
| D. | 标准状况下1mol该有机物可以与足量金属钠反应产生22.4L H2 |
| 选项 | M | N | 除杂试剂 | 除杂方法 |
| A | C2H5OH | H2O | 生石灰 | 蒸馏 |
| B | CH4 | CH2═CH2 | 酸性KMnO4溶液 | 洗气 |
| C | CH3COOCH2CH3 | CH3COOH、C2H5OH | NaOH溶液 | 分液 |
| D | 苯酚 | 三溴苯酚 | 水 | 过滤 |
| A. | A | B. | B | C. | C | D. | D |
①用分液法分离苯和溴苯的混合物
②用结晶法分离硝酸钾和氯化钠的混合物
③用分液法分离水和硝基苯的混合物
④用蒸馏法分离乙醇(沸点为78.5℃)和乙酸乙酯(沸点为77.5℃)的混合物.
| A. | ①④ | B. | ②③ | C. | ③④ | D. | ②④ |
| A | ①能使溴的四氯化碳溶液褪色; ②填充模型为 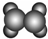 ; ;③能与水在一定条件下反应生成C. |
| B | ①由C、H两种元素组成; ②球棍模型为 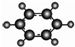 . . |
| C | ①由C、H、O三种元素组成; ②能与Na反应,但不能与NaOH溶液反应; ③能与D反应生成一种有香味的油状物. |
| D | ①由C、H、O三种元素组成; ②球棍模型为 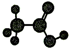 . . |
(1)A与溴的四氯化碳溶液反应的生成物的结构简式是CH2BrCH2Br.
A与水在一定条件下反应生成C的化学方程式是CH2=CH2+H2O$→_{△}^{催化剂}$CH3CH2OH
(2)A与氢气发生加成反应后生成物质E,E的组成符合通式CnH2n+2.
当n=C时,这类有机物开始出现同分异构体.
A.2 B.3 C.4 D.5
(3)B具有的性质是B.
A.无色无味液体,密度比水大 B.有毒,不溶于水
C.与酸性KMnO4溶液和溴水反应褪色 D.任何条件下不与氢气反应
写出在浓硫酸作用下,B与浓硝酸反应的化学方程式:
 +HO-NO2$→_{△}^{浓硫酸}$
+HO-NO2$→_{△}^{浓硫酸}$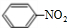 +H2O.
+H2O.(4)C与D反应生成的产物名称是乙酸乙酯,该反应的反应类型为取代反应或酯化反应.
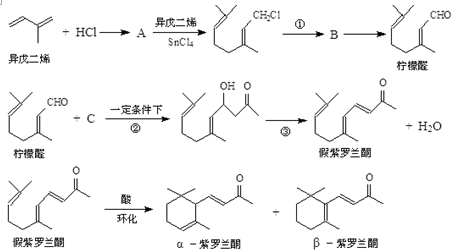
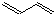 +Cl2$\stackrel{1,4加成}{→}$
+Cl2$\stackrel{1,4加成}{→}$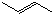
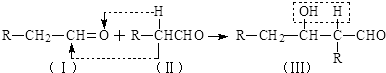
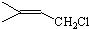 ,C的结构简式
,C的结构简式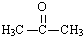 .
. .
. .
.
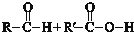 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$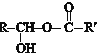
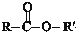 $?_{△}^{催化剂}$
$?_{△}^{催化剂}$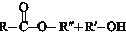
 .
. .
. 回答下列问题:
回答下列问题: ,乙的电子式为
,乙的电子式为 .
.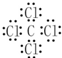 ,乙的化学式为NaCl.
,乙的化学式为NaCl.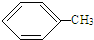 +3HO-NO2$\stackrel{浓硫酸}{→}$
+3HO-NO2$\stackrel{浓硫酸}{→}$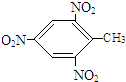 +3H2O.
+3H2O. .
.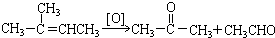
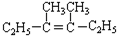 在上述类似条件下发生反应,请写出反应的方程式
在上述类似条件下发生反应,请写出反应的方程式 .
.