题目内容
13. (1)配制0.5mol/L的NaOH溶液,定容时向容量瓶中加蒸馏水超过刻度线,其结果偏小.(填“偏大”、“偏小”、或“不变”)
(1)配制0.5mol/L的NaOH溶液,定容时向容量瓶中加蒸馏水超过刻度线,其结果偏小.(填“偏大”、“偏小”、或“不变”)(2)从石油中分离出汽油、煤油和柴油等,所采用的方法是分馏.(填“干馏”或“分馏”)
(3)除去二氧化碳气体中的氯化氢杂质,选用的试剂是饱和NaHCO3溶液.(填“NaOH溶液”或“饱和NaHCO3溶液”)
(4)如图是实验室制取氨气的装置,回答下列问题:
①收集氨气的方法是向下排空气法.
②验证氨气是否收集满的方法是用湿润的红色石蕊试纸靠近塞棉花的试管口,若试纸变蓝色,说明收集满.(写一种)
分析 (1)根据c=$\frac{n}{V}$并结合溶质的物质的量n和溶液的体积V的变化来进行误差分析;
(2)从石油中分离出汽油、煤油和柴油等的操作为石油的分馏;
(3)根据CO2与饱和NaHCO3溶液不反应,而HCl能与饱和NaHCO3溶液生成CO2来分析;
(4)①氨气的密度比空气的小;
②根据氨气是唯一的碱性气体来分析.
解答 解:(1)配制0.5mol/L的NaOH溶液,定容时向容量瓶中加蒸馏水超过刻度线,会导致溶液体积偏大,则浓度偏小,
故答案为:偏小;
(2)根据石油中各组分的沸点不同从石油中分离出汽油、煤油和柴油等的操作为石油的分馏,
故答案为:分馏;
(3)CO2和HCl均为酸性气体,均能与NaOH溶液反应,而CO2与饱和NaHCO3溶液不反应,而HCl能与饱和NaHCO3溶液生成CO2,故除去二氧化碳气体中的氯化氢杂质,选用的试剂是饱和NaHCO3溶液,
故答案为:饱和NaHCO3溶液;
(4)①氨气的密度比空气的小,故采用向下排空气法,
故答案为:向下;
②氨气是唯一的碱性气体,故只要能证明有碱性气体逸出,则氨气已集满,故方法为用湿润的红色石蕊试纸靠近塞棉花的试管口,若试纸变蓝色,说明收集满,
故答案为:用湿润的红色石蕊试纸靠近塞棉花的试管口,若试纸变蓝色,说明收集满.
点评 本题考查了配制溶液时的误差分析、气体的除杂、实验室制取氨气等知识,(3)注意CO2与饱和NaHCO3溶液不反应,而HCl能与饱和NaHCO3溶液生成CO2,故除去二氧化碳气体中的氯化氢杂质,选用的试剂是饱和NaHCO3溶液,既为高频考点,又为易错点,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
20.pC类似于pH,是指极稀溶液中的溶质浓度的常用对数的负值.如某溶液中某溶液的浓度为1×10-3mlo/L,则该溶液中该溶质的pC=-1g(1×10-3)=3.如图为25℃时H2CO3溶液的pC-pH图(若离子浓度小于10-5mlo/L,可认为该离子不存在).下列说法不正确的是( )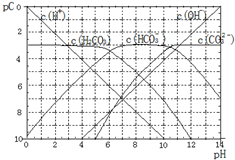

| A. | 某温度下,CO2饱和溶液的浓度是0.05mol•L-1,其中$\frac{1}{5}$的CO2转变为H2CO3,若此时溶液的pH约为5,据此可得该温度下CO2饱和溶液中H2CO3的电离度为0.1% | |
| B. | 25℃时,H2CO3一级电离平衡常数的数值Ka1=10-6 | |
| C. | 向Na2CO3溶液中滴加盐酸至pH等于11时,溶液中:c(Na+)+c(H+)=2c(CO${\;}_{3}^{2-}$)+c(OH-)+c(HCO${\;}_{3}^{-}$) | |
| D. | 25℃时,0.1mol/LNa2CO3中C(HCO${\;}_{3}^{-}$)比0.1mol/LH2CO3中C(HCO${\;}_{3}^{-}$)大 |
1.向四个体积相同的密闭容器中分别充入一定量的SO2和O2,
甲:500℃,10mol SO2和5mol O2反应;
乙:500℃,V2O5作催化剂,10mol SO2和5mol O2反应;
丙:450℃,8mol SO2和5mol O2反应;
丁:500℃,8mol SO2和5mol O2反应,
开始反应时,按反应速率由大到小的排列顺序正确的是( )
甲:500℃,10mol SO2和5mol O2反应;
乙:500℃,V2O5作催化剂,10mol SO2和5mol O2反应;
丙:450℃,8mol SO2和5mol O2反应;
丁:500℃,8mol SO2和5mol O2反应,
开始反应时,按反应速率由大到小的排列顺序正确的是( )
| A. | 甲、乙、丙、丁 | B. | 乙、甲、丙、丁 | C. | 乙、甲、丁、丙 | D. | 丁、丙、乙、甲 |
8.某固体混合物可能由Al、(NH4)2SO4、MgCl2、FeCl2、AlCl3中的两种或多种组成,现对该混合物做如下实验,所得现象和有关数据如图所示(气体体积数据已换算成标准状况下的体积):

关于该固体混合物,下列说法正确的是( )

关于该固体混合物,下列说法正确的是( )
| A. | 一定含有Al,其质量为2.7g | |
| B. | 一定含有(NH4)2SO4和MgCl2,且物质的量相等 | |
| C. | 一定含有MgCl2和FeCl2 | |
| D. | 一定不含FeCl2,可能含有MgCl2和AlCl3 |
18.已知1g氢气完全燃烧生成液态水时放出热量143kJ,18g水蒸气变成液态水放出44kJ的热量.其他相关数据如表:
则表中x为( )
| O═O | H-H | H-O(g) | |
| 1 mol化学键断裂时需要吸收的能量/kJ | 496 | 436 | x |
| A. | 920 | B. | 557 | C. | 463 | D. | 188 |
5.下列说法中正确的是( )
| A. | 乙烯、1,3-丁二烯、聚乙烯均能与溴水发生加成反应 | |
| B. | 实验室中要除去乙烷中混有的乙烯气体,可以用通入H2催化加氢的方法 | |
| C. | 沸点由高到低依次为:正戊烷>异戊烷>新戊烷>正丁烷>异丁烷 | |
| D. | 室温光照条件下,可以用CH4与氯气制取纯净的一氯甲烷,该反应属于取代反应 |
2.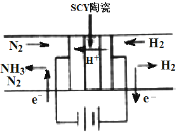 科学家采用高质子导电性的SCY陶瓷交换膜为质子导体,可以实现在低温常压条件下电化学方法合成氨,该方法N2和H2的转化率远高于现在工业上使用的氨合成法.其实验原理如图所示.下列关于电化学合成氨的叙述不正确的是( )
科学家采用高质子导电性的SCY陶瓷交换膜为质子导体,可以实现在低温常压条件下电化学方法合成氨,该方法N2和H2的转化率远高于现在工业上使用的氨合成法.其实验原理如图所示.下列关于电化学合成氨的叙述不正确的是( )
 科学家采用高质子导电性的SCY陶瓷交换膜为质子导体,可以实现在低温常压条件下电化学方法合成氨,该方法N2和H2的转化率远高于现在工业上使用的氨合成法.其实验原理如图所示.下列关于电化学合成氨的叙述不正确的是( )
科学家采用高质子导电性的SCY陶瓷交换膜为质子导体,可以实现在低温常压条件下电化学方法合成氨,该方法N2和H2的转化率远高于现在工业上使用的氨合成法.其实验原理如图所示.下列关于电化学合成氨的叙述不正确的是( )| A. | 阴极的电极反应是N2+6H++6e-=2NH3 | |
| B. | 阴极材料和阳极材料都可选用铁 | |
| C. | H2在阳极上发生反应是H2-2e-=2H+ | |
| D. | 该过程的总反应式是N2+3H2$\frac{\underline{\;电解\;}}{\;}$2NH3 |
3. 有机物的结构简式如图:则此有机物可发生的反应类型有( )
有机物的结构简式如图:则此有机物可发生的反应类型有( )
①取代 ②加成 ③消去 ④酯化 ⑤水解 ⑥氧化 ⑦中和 ⑧还原.
 有机物的结构简式如图:则此有机物可发生的反应类型有( )
有机物的结构简式如图:则此有机物可发生的反应类型有( )①取代 ②加成 ③消去 ④酯化 ⑤水解 ⑥氧化 ⑦中和 ⑧还原.
| A. | ①②③⑤⑥⑧ | B. | ②③④⑤⑥ | C. | ②③④⑤⑥⑦ | D. | ①②③④⑤⑥⑦⑧ |