题目内容
1.下述实验不能达到预期目的是:| 编号 | 实验内容 | 实验目的 |
| A | 用平行光照射 | 区别淀粉溶液和氯化钠溶液 |
| B | 加入CaCO3粉末,充分反应后过滤 | 除去CaCl2溶液中的FeCl3 |
| C | 通过灼烧的Cu粉末,收集气体 | 除去N2中的少量O2 |
| D | 滴入稀盐酸,同时用pH计测定至溶液呈中性 | 除去KNO3溶液中的KOH |
分析 A.胶体具有丁达尔现象;
B.碳酸钙促进氯化铁的水解;
C.Cu与氧气反应;
D.KOH与盐酸反应生成氯化钾.
解答 解:A.胶体具有丁达尔现象,则用平行光照射可鉴别胶体与溶液,故A正确;
B.碳酸钙促进氯化铁的水解,则加入CaCO3粉末,充分反应后过滤可除杂,故B正确;
C.Cu与氧气反应,而氮气不能,通过灼烧的Cu粉末,收集气体可除杂,故C正确;
D.KOH与盐酸反应生成氯化钾,引入新杂质KCl,不能除杂,故D错误;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质及混合物分离提纯方法、盐类水解等为解答的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
相关题目
11.化学与科学、技术、社会、环境密切相关.下列有关说法中不正确的是( )
| A. | 工业上,用焦炭在电炉中还原二氧化硅得到含杂质的粗硅 | |
| B. | 煤经过气化和液化两个物理变化,可变为清洁能源 | |
| C. | 如将纳米材料分散到液体分散剂中,该分散系可发生丁达尔现象,由此可推测纳米材料的直径为1~100 nm之间 | |
| D. | 将苦卤浓缩、氧化,鼓入热空气或水蒸气提取海水中的溴,溴元素又称“海洋元素” |
9.升高温,下列溶液的pH不变的是( )
| A. | NaCl溶液 | B. | NaOH溶液 | C. | NaHSO3溶液 | D. | NaHSO4溶液 |
16.硫酸是重要的化工原料,生产过程中SO2催化氧化生成SO3的化学反应为:2SO2(g)+O2(g)$\frac{\underline{催化剂}}{△}$2SO3(g).
(1)实验测得SO2反应生成SO3的转化率与温度、压强有关,请根据表信息,结合工业生产实际,选择最合适的生产条件是400℃,1个标准大气压.
(2)反应2SO2(g)+O2(g)$\frac{\underline{催化剂}}{△}$2SO3(g)达到平衡后,改变下列条件,能使SO2(g)平衡时的浓度比原来减小的是AC(填字母).
A.保持温度和容器体积不变,充入1mol O2(g)
B.保持温度和容器体积不变,充入2mol SO3 (g)
C.降低温度
D.在其他条件不变时,减小容器的容积.
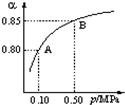
(3)某温度下,SO2的平衡转化率(α)与体系总压强(P)的关系如图所示,2.0mol SO2和1.0mol O2置于10L密闭容器中,反应达平衡后,体系总压强为0.10MPa.平衡状态由A编导B时,平衡常数K(A)=K(B)(填“<”,“>”,或“=”),B点的化学平衡常数是800.
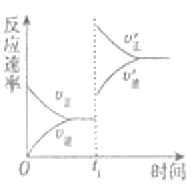
 (4)在一个固定容器为5L的密闭容器中充入0.20mol SO2(g)和0.10mol O2(g),t1时刻达到平衡,测得容器中含SO30.18mol.①t1时刻达到平衡后,改变一个条件使化学反应速度发生如图所示的变化,则改变的条件是C.
(4)在一个固定容器为5L的密闭容器中充入0.20mol SO2(g)和0.10mol O2(g),t1时刻达到平衡,测得容器中含SO30.18mol.①t1时刻达到平衡后,改变一个条件使化学反应速度发生如图所示的变化,则改变的条件是C.
A.体积不变,向容器中通入少量O2
B.体积不变,向容器中通入少量SO2
C.缩小容器体积
D.升高温度
E.体积不变,向容器中通入少量氮气
②若继续通入0.20mol SO2和0.10mol O2,则平衡向正反应方向移动(填“向正反应方向”、“向逆反应方向”或“不”),再次达到平衡后,0.36 mol<n(SO3)<0.40mol.
(1)实验测得SO2反应生成SO3的转化率与温度、压强有关,请根据表信息,结合工业生产实际,选择最合适的生产条件是400℃,1个标准大气压.
| 压强 SO2转化率 温度 | 1个大气压 | 5个大气压 | 10个大气压 | 15个大气压 |
| 400℃ | 0.9961 | 0.9972 | 0.9984 | 0.9988 |
| 500℃ | 0.9675 | 0.9767 | 0.9852 | 0.9894 |
| 600℃ | 0.8520 | 0.8897 | 0.9276 | 0.9468 |
A.保持温度和容器体积不变,充入1mol O2(g)
B.保持温度和容器体积不变,充入2mol SO3 (g)
C.降低温度
D.在其他条件不变时,减小容器的容积.
(3)某温度下,SO2的平衡转化率(α)与体系总压强(P)的关系如图所示,2.0mol SO2和1.0mol O2置于10L密闭容器中,反应达平衡后,体系总压强为0.10MPa.平衡状态由A编导B时,平衡常数K(A)=K(B)(填“<”,“>”,或“=”),B点的化学平衡常数是800.
 (4)在一个固定容器为5L的密闭容器中充入0.20mol SO2(g)和0.10mol O2(g),t1时刻达到平衡,测得容器中含SO30.18mol.①t1时刻达到平衡后,改变一个条件使化学反应速度发生如图所示的变化,则改变的条件是C.
(4)在一个固定容器为5L的密闭容器中充入0.20mol SO2(g)和0.10mol O2(g),t1时刻达到平衡,测得容器中含SO30.18mol.①t1时刻达到平衡后,改变一个条件使化学反应速度发生如图所示的变化,则改变的条件是C.A.体积不变,向容器中通入少量O2
B.体积不变,向容器中通入少量SO2
C.缩小容器体积
D.升高温度
E.体积不变,向容器中通入少量氮气
②若继续通入0.20mol SO2和0.10mol O2,则平衡向正反应方向移动(填“向正反应方向”、“向逆反应方向”或“不”),再次达到平衡后,0.36 mol<n(SO3)<0.40mol.

6.有一不饱和的K0H溶液,加入xmolK2O或ymolK2O2或zmolK0H,均恰好得到同温度下的饱和K0H溶液,则x、y、z的关系正确的是( )
| A. | z>y>x | B. | x=y>2z | C. | x=y<$\frac{z}{2}$ | D. | x=y>$\frac{z}{2}$ |
20. 用铅蓄电池电解甲、乙电解池中的溶液.已知铅蓄电池的总反应为:Pb+PbO2+2H2SO4═2PbSO4+2H2O,电解一段时间后向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是( )
用铅蓄电池电解甲、乙电解池中的溶液.已知铅蓄电池的总反应为:Pb+PbO2+2H2SO4═2PbSO4+2H2O,电解一段时间后向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是( )
 用铅蓄电池电解甲、乙电解池中的溶液.已知铅蓄电池的总反应为:Pb+PbO2+2H2SO4═2PbSO4+2H2O,电解一段时间后向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是( )
用铅蓄电池电解甲、乙电解池中的溶液.已知铅蓄电池的总反应为:Pb+PbO2+2H2SO4═2PbSO4+2H2O,电解一段时间后向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是( )| A. | d极为阴极 | |
| B. | 放电时铅蓄电池负极的电极反应式为:PbO2+4H++SO42-+4e-═PbSO4+2H2O | |
| C. | 若利用甲池精炼铜,b极应为粗铜 | |
| D. | 若电极材料均为石墨,当析出6.4g Cu时,两池共产生气体3.36L(标准状况下) |

 .
.