题目内容
10.现有常见金属单质A、B、C和常见气体甲、乙、丙及物质D、E、F、G、H,它们之间能发生如图反应(图中有些反应的产物和反应的条件没有全部标出).请根据以上信息回答下列问题:
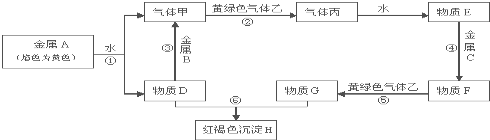
(1)写出下列物质的化学式:AFeBAl FFeCl2 丙HCl
(2)写出下列反应离子方程式:反应③2Al+2H2O+2OH-=2AlO2-+3H2↑,反应⑤2Fe2++Cl2=2Fe3++2Cl-,反应⑥Fe3++3OH-=Fe(OH)3↓.
分析 金属A的焰色反应为黄色,则A为Na,结合图中转化可知,甲为氢气,D为NaOH,黄绿色气体乙为氯气,则丙为HCl,E为盐酸,结合F可被氯气氧化,D与G反应生成红褐色沉淀H为Fe(OH)3,则金属C为Fe,F为FeCl2,G为FeCl3,D与B反应生成氢气,B为金属Al,以此来解答.
解答 解:金属A的焰色反应为黄色,则A为Na,结合图中转化可知,甲为氢气,D为NaOH,黄绿色气体乙为氯气,则丙为HCl,E为盐酸,结合F可被氯气氧化,D与G反应生成红褐色沉淀H为Fe(OH)3,则金属C为Fe,F为FeCl2,G为FeCl3,D与B反应生成氢气,B为金属Al,
(1)由上述分析可知,A为Na,B为Al,F为FeCl2,丙为HCl,故答案为:Na;Al;FeCl2;HCl;
(2)③⑤⑥的离子反应分别为2Al+2H2O+2OH-=2AlO2-+3H2↑、2Fe2++Cl2=2Fe3++2Cl-、Fe3++3OH-=Fe(OH)3↓,
故答案为:2Al+2H2O+2OH-=2AlO2-+3H2↑;2Fe2++Cl2=2Fe3++2Cl-;Fe3++3OH-=Fe(OH)3↓.
点评 本题考查无机物的推断,为高频考点,把握金属及化合物的性质、物质的相互转化为解答的关键,侧重分析与推断能力的考查,注意发生的氧化还原反应,A、乙、H为推断的突破口,题目难度不大.

练习册系列答案
相关题目
20.设NA表示阿伏伽德罗常数,下列叙述中正确的是( )
| A. | 23gNa与足量水反应中转移的电子数目为NA | |
| B. | 30g乙烷含有的共价键数目为8NA | |
| C. | 25℃,1.01×105 Pa下,使1 mol氯化氢气体溶于1 L水中,所得溶液的物质的量浓 度为1 mol•L-1 | |
| D. | 常温常压下,11.2LSO3含有的氧原子数为1.5NA |
1.除去下列物质中的杂质(括号内为杂质),填写下表:
| 物质 | 选用试剂 | 操作方法 | 化学反应方程式 |
| C(MnO2) | |||
| KCl(KBr) | |||
| Cl2(HCl) | / | ||
| Na2SO4(Na2SO3) |
18.与50mL0.5mol/L的(NH4)2SO4溶液中,c(NH4+)浓度相同的是( )
| A. | 100mL1mol/L的氨水 | B. | 200mL1mol/L的NH4Cl | ||
| C. | 50mL0.5mol/L的CH3COONH4溶液 | D. | 50mL0.5mol/L的NH4NO3 |
5.将下列单质跟一定量的金属氧化物粉末混合加热,不能得到相应氧化物中的金属的是( )
| A. | Fe3O4与铝粉 | B. | Al2O3与铁粉 | C. | CuO与炭粉 | D. | Fe2O3与炭粉 |
15.下列离子方程式正确的是( )
| A. | 硫酸铜溶液与氢氧化钡溶液反应:SO42-+Ba2+═BaSO4↓ | |
| B. | 将大理石投入到足量盐酸中:CO32-+2H+═CO2↑+H2O | |
| C. | 将Cl2通入KI溶液中:2I-+Cl2═2Cl-+I2 | |
| D. | 碳酸钠溶液显碱性:CO32-+H2O═HCO3-+OH- |
19.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 19g H3O+共用的电子对数为2NA | |
| B. | 常温下,1L0.1mol/L AlCl3溶液中阳离子数小于0.1NA | |
| C. | 标准状况下,1.4gN2和CO的混合气体中含有的电子数为0.7NA | |
| D. | 200mL2.5mol/L乙醇溶液中含有的分子总数为0.5NA |
19.在“绿色化学工艺”中,理想状态是原子利用率为100%.在用CH3C≡CH合成CH2=C(CH3)COOCH3的过程中,欲使原子利用率达到最高,还需要的其它反应物有( )
| A. | CO和CH3OH | B. | CO2和H2O | C. | H2和CO2 | D. | CH3OH和H2 |