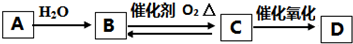题目内容
20.氧化还原反应的实质是( )| A. | 是否有电子转移 | |
| B. | 同一元素的化合价在反应前后是否有变化 | |
| C. | 是否有氧元素参加 | |
| D. | 是否是化合反应或分解反应 |
分析 氧化还原反应的特征为化合价变化,本质为电子的得失或偏移,以此来解答.
解答 解:氧化还原反应的本质是电子的得失或偏移,与是否同种元素的化合价变化、是否有氧参加、与分解与化合反应等无关,
故选A.
点评 本题考查氧化还原反应的本质,为高频考点,把握本质、特征及基本概念为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
10.X、Y、Z、W是元素周期表前四周期中常见的元素,原子序数依次增大.其相关信息如下表:
(1)X的电负性比Y的小(填“大”或“小”);X 和Y的气态氢化物中,较稳定的是H2O(写化学式).
(2)W在周期表中的位置是第四周期第Ⅷ族,其基态原子价电子的电子排布式为3d64s2.
(3)Z2Y2的电子式为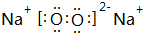 ,请写出Z2Y2与XY2反应的化学方程式2Na2O2+2CO2=2Na2CO3+O2.
,请写出Z2Y2与XY2反应的化学方程式2Na2O2+2CO2=2Na2CO3+O2.
(4)在XY2分子中X原子的杂化方式为sp,其分子的空间构型为直线形.氢、X、Y三种元素可共同形成多种分子和一种常见无机阴离子,写出其中一种分子与该无机阴离子反应的离子方程式:HCO3-+CH3COOH=CH3COO-+CO2↑+H2O.
| 元素 | 相关信息 |
| X | X的基态原子价层电子中有两个未成对电子 |
| Y | Y的基态原子最外层电子排布式为:nsnnpn+2 |
| Z | Z存在质量数为23,中子数为12的核素 |
| W | W有多种化合价,其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色 |
(2)W在周期表中的位置是第四周期第Ⅷ族,其基态原子价电子的电子排布式为3d64s2.
(3)Z2Y2的电子式为
 ,请写出Z2Y2与XY2反应的化学方程式2Na2O2+2CO2=2Na2CO3+O2.
,请写出Z2Y2与XY2反应的化学方程式2Na2O2+2CO2=2Na2CO3+O2.(4)在XY2分子中X原子的杂化方式为sp,其分子的空间构型为直线形.氢、X、Y三种元素可共同形成多种分子和一种常见无机阴离子,写出其中一种分子与该无机阴离子反应的离子方程式:HCO3-+CH3COOH=CH3COO-+CO2↑+H2O.
8.下列解释事实的离子方程式正确的是( )
| A. | NaHCO3溶液与NaOH溶液反应:OH-+HCO3-=CO32-+H2O | |
| B. | Na放入水中,产生气体:Na+H2O=Na++OH-+H2↑ | |
| C. | 实验室用大理石和稀盐酸制取CO2:2H++CO32-=CO2↑+H2O | |
| D. | 向AlCl3溶液中加入过量的NaOH溶液:Al3++3OH-=Al(OH)3↓ |
15.下列离子的检验方法中正确的是( )
| A. | 某溶液加AgNO3溶液生成白色沉淀,说明原溶液中有Cl- | |
| B. | 某溶液加BaCl2溶液生成白色沉淀,说明原溶液中有SO42- | |
| C. | 某溶液加NaOH溶液生成蓝色沉淀,说明原溶液中有Mg2+ | |
| D. | 某溶液加NaOH溶液生成红褐色沉淀,说明原溶液中有Fe3+ |
5.下列物质既属于无机物,又属于碱的是( )
| A. | Na2CO3 | B. | CH3OH | C. | Al2O3 | D. | Cu(OH)2 |
9.下列各组顺序的排列不正确的是( )
| A. | 原子半径:F>Na>Mg>Al | B. | 热稳定性:HCl>H2S>PH3 | ||
| C. | 酸性强弱:H2CO3<H3PO4<H2SO4 | D. | 碱性强弱:KOH>NaOH>Mg(OH)2 |