题目内容
6. 氨气是一种重要的物质,可用于制取化肥和硝酸等.
氨气是一种重要的物质,可用于制取化肥和硝酸等.(1)工业合成氨的热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-92kJ/mol
| N-H | H-H | N≡N | |
| 断开1mol化学键需要吸收的能量/kJ | a | 436 | 946 |
(2)合成按原料中的H2可用CO在高温下与水蒸气反应制得.
已知在25℃、101kPa下:
Ⅰ2C(石墨,s)+O2(g)═2CO(g)△H1=-222kJ/mol
Ⅱ2H2(g)+O2(g)═2H2O(g)△H2=-242kJ/mol
ⅢC(石墨,s)+O2(g)═CO2(g)△H3=-394kJ/mol
①25℃、101kPa下CO与水蒸气反应转化为H2的热化学方程式为:CO(g)+H2O(g)=CO2(g)+H2(g)△H4=-162kJ/mol.
②根据Ⅰ、Ⅱ、Ⅲ反应下列说法正确的是a(选填选项字母).
a.由反应Ⅱ可以推知:2H2(g)+O2(g)=2H2O(l)△H4,则△H4小于△H2
b.反应Ⅲ的反应热等于O2分子中化学键断裂时所吸收的总能量与CO2分子中化学键形成时所释放的总能量的差
(3)有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制取新型燃料电池.请写出该电池的正极反应式N2+6e-+8H+=2NH4+.
分析 (1)焓变等于反应物中键能之和减去生成物中键能之和,以此来解答;
(2)①Ⅰ2C(石墨,s)+O2(g)═2CO(g)△H1=-222kJ/mol
Ⅱ2H2(g)+O2(g)═2H2O(g)△H2=-242kJ/mol
ⅢC(石墨,s)+O2(g)═CO2(g)△H3=-394kJ/mol,Ⅲ-$\frac{Ⅰ}{2}-\frac{Ⅱ}{2}$得CO(g)+H2O(g)=CO2(g)+H2(g),据此进行分析;
②水蒸气生成液态水时放出热量;
焓变=反应物断裂化学键吸收的能量-生成物形成化学键放出的能量;
(3)N2在正极发生还原反应生成NH4+,以此书写电极反应式.
解答 解:(1)由N2(g)+3H2(g)?2NH3(g)△H=-92kJ•mol-1及表格数据可知,946kJ+3×436kJ-6a=-92kJ,解得a=391kJ,
故答案为:391kJ;
(2)①Ⅰ2C(石墨,s)+O2(g)═2CO(g)△H1=-222kJ/mol
Ⅱ2H2(g)+O2(g)═2H2O(g)△H2=-242kJ/mol
ⅢC(石墨,s)+O2(g)═CO2(g)△H3=-394kJ/mol,Ⅲ-$\frac{Ⅰ}{2}-\frac{Ⅱ}{2}$得CO(g)+H2O(g)=CO2(g)+H2(g)△H4=-162kJ/mol,故CO与水蒸气反应转化为H2的热化学方程式为CO(g)+H2O(g)=CO2(g)+H2(g)△H4=-162kJ/mol,
故答案为:CO(g)+H2O(g)=CO2(g)+H2(g)△H4=-162kJ/mol;
②液态水变成水蒸气需要吸收能量,所以生成水蒸气比生成液态水放出的热量少,故则△H4小于△H2,故a正确;
该反应的反应热等于O2分子和碳中化学键断裂时所吸收的总能量与CO2分子中化学键形成时所释放的总能量的差,故b错误,
故答案为:a;
(3)以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制取新型燃料电池,N2在正极发生还原反应生成NH4+,电极反应式为N2+6e-+8H+=2NH4+,
故答案为:N2+6e-+8H+=2NH4+.
点评 本题考查反应热与焓变,物质状态与所含能量多少的关系、原电池电极反应方程式的书写,题目难度不大.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 当镀层都被破坏时,镀锌铁比镀锡铁更易被锈蚀 | |
| B. | 钢铁发生析氢腐蚀时和吸氧腐蚀时负极反应均是Fe-2e-=Fe2+ | |
| C. | 钢铁闸门上装上锌块是利用牺牲阳极的阴极保护法来防止其被腐蚀 | |
| D. | 钢管与电源负极连接是利用外加电流的阴极保护法来防止其被腐蚀 |
| A. | 水 | B. | 酒精 | ||
| C. | 酸性高锰酸钾溶液 | D. | 氢氧化钠溶液 |
| A. | 向碳酸氢钠溶液中加入少量氢氧化钙溶液HCO3-+OH-+Ca2+═CaCO2↓+H2O | |
| B. | 在高温氧化锆的环境下,CO的燃料电池的负极反应2CO+2O2--4e-═2CO2 | |
| C. | 硫化钠的水解方程式S2-+2H2O?H2S+2OH- | |
| D. | 电解硫酸钠水溶液的阳极反应2H++2e-═H2↑ |
4NH3+3F2=NF3+3NH4F.下列有关NF3的叙述不正确的是( )
| A. | NF3是一种极性分子 | B. | NF3提供孤电子对的能力比NH3强 | ||
| C. | NF3中的N呈+3价 | D. | NF3中的N采取sp3杂化成键 |


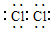 ,M的学化式为NaClO.
,M的学化式为NaClO.