题目内容
1.工业上对海水资源综合开发利用的部分工艺流程如图所示:
(1)物质C和M均为强氧化性物质,则C的电子式为
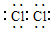 ,M的学化式为NaClO.
,M的学化式为NaClO.(2)反应⑤的化学方程式是MgCl2(熔融)$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑.
(3)实验工业中常以海带为原料提取碘单质.实验室模拟该流程时,其中一个步骤是向海带灰溶解后的滤液中先滴入几滴稀硫酸,然后加入一定量的溶液X.则X溶液可以是BD.
A.HCl溶液B.H2O2溶液C.氨水D.Cl2水.
分析 海水晒盐利用氯化钠溶解度随温度变化不大得到粗盐和母液,粗盐精制除杂得到精盐,电解饱和食盐水得到氢氧化钠、氢气和氯气,则C为Cl2,氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,氯气和氢气反应生成N为HCl,贝壳煅烧生成A为氧化钙,氧化钙溶于水生成B为氢氧化钙,加入母液中测定镁离子生成氢氧化镁沉淀,过滤壶沉淀中加入盐酸溶解得到氯化镁溶液,浓缩结晶干燥得到固体氯化镁,电解熔融氯化镁生成镁和氯气,
(1)物质C和M均为强氧化性物质,分析判断C为Cl2,M为NaClO;
(2)反应⑤电解熔融氯化镁生成镁和氯气;
(3)滴入的溶液能氧化碘离子生成单质碘;
解答 解:海水晒盐利用氯化钠溶解度随温度变化不大得到粗盐和母液,粗盐精制除杂得到精盐,电解饱和食盐水得到氢氧化钠、氢气和氯气,则C为Cl2,氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,氯气和氢气反应生成N为HCl,贝壳煅烧生成A为氧化钙,氧化钙溶于水生成B为氢氧化钙,加入母液中测定镁离子生成氢氧化镁沉淀,过滤壶沉淀中加入盐酸溶解得到氯化镁溶液,浓缩结晶干燥得到固体氯化镁,电解熔融氯化镁生成镁和氯气,
(1)物质C和M均为强氧化性物质,分析判断C为Cl2,氯原子间形成一对共用电子对,则C的电子式为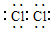 ,M为NaClO,溶液中次氯酸根离子有氧化性,
,M为NaClO,溶液中次氯酸根离子有氧化性,
故答案为: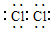 ;NaClO;
;NaClO;
(2)电解熔融氯化镁生成镁和氯气,反应的化学方程式为:MgCl2(熔融)$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑,
故答案为:MgCl2(熔融)$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑;
(3)向海带灰溶解后的滤液中先滴入几滴稀硫酸,然后加入一定量的溶液X具有氧化性能氧化碘离子生成碘单质,选项中过氧化氢在酸溶液中具有氧化性能氧化碘离子,氯气能氧化碘离子生成碘单质,故选BD,
故答案为:BD.
点评 本题考查了从海水中提取镁的反应原理、粗盐提纯后的烧碱工业和产物应用,利用所学知识结合流程图信息是解答本题的关键,题目难度不大.

 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案| A. | 上述反应,每生成lmolN2O,消耗67.2LCO | |
| B. | 等物质的量的NO和CO含有相等的电子数 | |
| C. | N2O只有氧化性,无还原性 | |
| D. | CO会迅速与人体血红蛋白结合,使人中毒 |
 氨气是一种重要的物质,可用于制取化肥和硝酸等.
氨气是一种重要的物质,可用于制取化肥和硝酸等.(1)工业合成氨的热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-92kJ/mol
| N-H | H-H | N≡N | |
| 断开1mol化学键需要吸收的能量/kJ | a | 436 | 946 |
(2)合成按原料中的H2可用CO在高温下与水蒸气反应制得.
已知在25℃、101kPa下:
Ⅰ2C(石墨,s)+O2(g)═2CO(g)△H1=-222kJ/mol
Ⅱ2H2(g)+O2(g)═2H2O(g)△H2=-242kJ/mol
ⅢC(石墨,s)+O2(g)═CO2(g)△H3=-394kJ/mol
①25℃、101kPa下CO与水蒸气反应转化为H2的热化学方程式为:CO(g)+H2O(g)=CO2(g)+H2(g)△H4=-162kJ/mol.
②根据Ⅰ、Ⅱ、Ⅲ反应下列说法正确的是a(选填选项字母).
a.由反应Ⅱ可以推知:2H2(g)+O2(g)=2H2O(l)△H4,则△H4小于△H2
b.反应Ⅲ的反应热等于O2分子中化学键断裂时所吸收的总能量与CO2分子中化学键形成时所释放的总能量的差
(3)有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制取新型燃料电池.请写出该电池的正极反应式N2+6e-+8H+=2NH4+.
| A. | 乙酸 | B. | 乙醇 | C. | 乙烯 | D. | 氯乙烯 |
| A. | 是旧键断裂新键形成的过程 | B. | 都有能量变化 | ||
| C. | 都有新物质生成 | D. | 都需要加热 |
 .
. .
. ,钠离子核外能量最高的电子位于2p层,比较离子半径大小:r(Na+)<r(O2-)(填“>”,“<”或“=”)
,钠离子核外能量最高的电子位于2p层,比较离子半径大小:r(Na+)<r(O2-)(填“>”,“<”或“=”) ,
, ;C2B2的电子式为
;C2B2的电子式为 .
.