题目内容
下列实验操作和对应的现象、结论都正确的是( )
| 选项 | 操作 | 现象 | 结论 |
| A | 将饱和FeCl3溶液滴入沸水中 | 溶液变红褐色 | 有Fe(OH)3生成 |
| B | 用燃烧的镁条引燃铝热剂 | 剧烈反应 | 该反应是吸热反应 |
| C | 向溶液中滴加盐酸酸化的BaCl2溶液 | 产生白色沉淀 | 溶液中含有SO42- |
| D | 用导线连接铜片和锌片后插进盐酸中 | 铜片上有气泡 | 铜片是原电池的正极 |
| A、A | B、B | C、C | D、D |
考点:化学实验方案的评价,硫酸根离子的检验,探究吸热反应和放热反应,探究原电池及其工作原理
专题:实验评价题
分析:A.铁离子在沸水中水解得到胶体;
B.铝热反应为放热反应;
C.白色沉淀可能为AgCl;
D.铜片和锌片后插进盐酸中,Zn为负极,Cu为正极.
B.铝热反应为放热反应;
C.白色沉淀可能为AgCl;
D.铜片和锌片后插进盐酸中,Zn为负极,Cu为正极.
解答:
解:A.铁离子在沸水中水解得到胶体,且为红褐色液体,故A正确;
B.铝热反应为放热反应,结论不合理,故B错误;
C.向溶液中滴加盐酸酸化的BaCl2溶液,产生白色沉淀,原溶液中可能含银离子,可能含硫酸根离子,但二者不能同时存在,故C错误;
D.铜片和锌片后插进盐酸中,Zn为负极,Cu为正极,正极上氢离子得到电子生成氢气,故D正确;
故选AD.
B.铝热反应为放热反应,结论不合理,故B错误;
C.向溶液中滴加盐酸酸化的BaCl2溶液,产生白色沉淀,原溶液中可能含银离子,可能含硫酸根离子,但二者不能同时存在,故C错误;
D.铜片和锌片后插进盐酸中,Zn为负极,Cu为正极,正极上氢离子得到电子生成氢气,故D正确;
故选AD.
点评:本题考查化学实验方案的评价,为高频考点,涉及胶体制备、铝热反应、离子检验及原电池等,侧重化学反应原理及实验方案评价性、操作性考查,选项C为解答的易错点,题目难度不大.

练习册系列答案
 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案
相关题目
下列反应的离子方程式正确的是( )
A、溶质物质的量相等的Ba(OH)2与KAl(SO4)2?12H2O溶液混合:Ba2++6OH-+2Al3++SO
| ||||
| B、Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+═Fe3++3H2O | ||||
C、向NaAlO2溶液中通入过量CO2制Al(OH)3:AlO
| ||||
D、将适量CO2通入Ca(ClO)2溶液中:2ClO-+CO2+H2O═CO
|
下列事实不能用电化学理论解释的是( )
| A、轮船水线以下的船壳上镶嵌有一定量的锌块 |
| B、黄铜(铜锌合金)制作的铜锣不易产生铜绿 |
| C、锌跟稀硫酸反应制取氢气,加入少量硫酸铜能加快反应速率 |
| D、铝在空气中不易腐蚀,不用特殊方法保存 |
下列叙述不正确的是( )
| A、相同物质的量浓度的①CH3COONa溶液②NaNO3溶液③NH4Cl溶液④NaOH溶液,pH的大小顺序是:④>①>②>③ |
| B、在Na2SO3和NaHSO3混合液中:c(Na+)+c(H+)=c(HSO3-)+c(OH-)+2c(SO32-) |
| C、相同条件下,pH=10的CH3COONa溶液和氨水中,由水电离出的c(OH-)前者大于后者 |
| D、某溶液中只含Na+、CH3COO-、H+、OH-四种离子,则溶液一定呈现碱性 |
下列离子方程式书写正确的是( )
| A、过量的SO2通人NaOH溶液中:SO2+2OH-=SO32-+H2O |
| B、Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-=2Fe2++I2 |
| C、碳酸氢钠溶液与足量氢氧化钡溶液混合:HCO3-+Ba2++OH-=BaCO3↓+H2O |
| D、少量金属钠加到冷水中:Na+2H2O=Na++OH-+H2↑ |
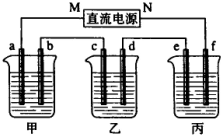 如图所示装置中,甲,乙、丙三个烧杯依次分别盛放100g5.00%nNaOH溶液、足量的CuSO4溶液和100g9.55%的K2SO4溶液,电极均为石墨电极.接通电源,经过一段时间后,测得丙中K2SO4浓度为10.00%,乙中c电极质量增加,据此回答问题:
如图所示装置中,甲,乙、丙三个烧杯依次分别盛放100g5.00%nNaOH溶液、足量的CuSO4溶液和100g9.55%的K2SO4溶液,电极均为石墨电极.接通电源,经过一段时间后,测得丙中K2SO4浓度为10.00%,乙中c电极质量增加,据此回答问题:



