题目内容
17.某市对大气进行检测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5um的悬浮颗粒物)其主要来源为燃烧、机动车尾气等.因此,对PM2.5、SO2、NO等进行研究具有重要意义.回答下列问题:(1)已知:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3KJ/mol
N2(g)+O2(g)═2NO(g)△H=+180KJ/mol
CH4可用于燃烧脱硝,CH4(g)+4NO(g)═CO2(g)+2N2(g)+2H2O(l)△H=-1250.3kJ/mol.
(2)汽车尾气中NOx和CO的生成及转化
①已知气缸中生成NO的反应为:N2(g)+O2(g)?2NO(g)△H>0
汽车启动后,气缸温度较高,单位时间内NO排放量越大,原因是温度升高,反应速率加快;温度升高,有利于平衡反应正向进行.
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO;
2CO(g)═2C(s)+O2(g)已知反应的△H>0,简述该设想能否实现的依据否,该反应是焓增、熵减的反应,任何温度下均不能自发进行.
③目前,在汽车尾气系统中安装催化转化器可减少CO和NO的污染,其化学方程式为2CO+2NO$\frac{\underline{\;催化剂\;}}{\;}$2CO2+N2.
(3)一定温度下,在密闭容器中反应2NO2(g)?N2O4(g)△H=-57.20KJ/mol达到平衡.其他条件不变时,下列措施能提高NO2转化率的是bc(填字母)
a.减小NO2的浓度 b.降低温度 c.增加NO2的浓度 d.升高温度
在一定温度和压强下,密闭容器中N2O4和NO2的混合气体达到平衡时,c(N2O4)=0.0120mol/L(已知2NO2(g)?N2O4(g)反应在该温度下的平衡常数K=$\frac{40}{3}$).计算平衡时NO2物质的量浓度为0.030mol/L.
分析 (1)已知:①CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3kJ•mol-1
②N2(g)+O2(g)═2NO(g)△H=+180kJ•mol-1
根据盖斯定律:①-2×②得CH4(g)+4NO(g)═CO2(g)+2N2(g)+2H2O(l),据此计算;
(2)①依据影响化学反应速率和化学平衡的因素分析判断;
②依据反应自发进行的条件是△H-T△S<0分析判断;
③在汽车尾气系统中安装催化转化器可将CO和NO转化为氮气和二氧化碳;
(3)该反应是反应前后气体体积减小的、放热的可逆反应,要提高二氧化氮的转化率,只要改变条件使化学平衡向正反应方向移动即可;
根据平衡常数表达式结合三行式来计算物质的平衡浓度.
解答 解:(1)已知:①CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3kJ•mol-1,②N2(g)+O2(g)═2NO(g)△H=+180kJ•mol-1
根据盖斯定律:①-2×②得CH4(g)+4NO(g)═CO2(g)+2N2(g)+2H2O(l),△H=-890.3kJ•mol-1-2×(+180kJ•mol-1)=-1250.3 kJ•mol-1,
故答案为:-1250.3kJ/mol;
(2)①N2(g)+O2(g)═2NO(g)△H>0,反应时气体体积不变的吸热反应,温度升高,反应速率加快,平衡右移,单位时间内NO排放量越大;
故答案为:温度升高,反应速率加快;温度升高,有利于平衡反应正向进行;
②2CO(g)=2C(s)+O2(g)△H>0,反应是焓变增大,熵变减小的反应,△H>0,△S<0,则△H-T△S>0,反应任何温度下都不能自发进行;
故答案为:否,该反应是焓增、熵减的反应,任何温度下均不能自发进行;
③在汽车尾气系统中安装催化转化器可减少CO和NO的污染,生成产物为二氧化氮和氮气,反应的化学方程式为:2CO+2NO$\frac{\underline{\;催化剂\;}}{\;}$2CO2+N2,
故答案为:2CO+2NO$\frac{\underline{\;催化剂\;}}{\;}$2CO2+N2;
(3)该反应是反应前后气体体积减小的、放热的可逆反应,要使该反应向正反应方向移动,可改变反应物的浓度、体系的压强、温度等.
a.减小N02的浓度,平衡向逆反应方向移动,N02的转化率降低,故a错误;
b.降低温度,平衡向正反应方向移动,N02的转化率提高,故b正确;
c.增加N02的浓度,平衡向正反应方向移动,且体系压强增大,也利于反应向正反应方向移动,故c正确;
c.升高温度,平衡向逆反应方向移动,N02的转化率降低,故c错误;
根据题意知平衡时:c(N2O4)=0.0120mol/L,设c(NO2)=xmol/L,则 K=$\frac{0.012}{{x}^{2}}$=$\frac{40}{3}$,解得:x=0.030mol/L,
故答案为:bc;c(NO2)=0.030mol/L.
点评 本题考查较为综合,涉及化学平衡计算、反应热与焓变、氮的氧化物性质应用等知识,题目难度中等,注意掌握盖斯定律的内容及应用方法,明确化学平衡常数的概念及表达式,试题培养了学生的分析、理解能力及化学计算能力.

| A. | 2x | B. | 4 | C. | 2y | D. | 2 |
| A. | 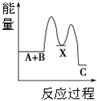 反应A+B→C(△H<0)分两步进行:①A+B→X(△H>0),②X→C(△H<0),图表示总反应过程中能量变化 | |
| B. | 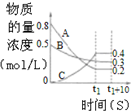 图表示反应的化学方程式为3A+B═2C | |
| C. | 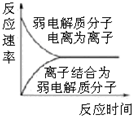 图表示弱电解质在水中建立电离平衡的过程 | |
| D. | 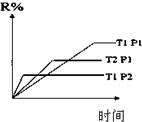 图表示反应M(g)+N(g)?R(g)+2L(?)是放热反应且L是气体 |
| A. | c(I-)=0.1mol•L-1的溶液中:K+、Na+、SO42-、ClO- | |
| B. | 使甲基橙变红色的溶液中:K+、NH4+、HCO3-、Cl- | |
| C. | 与Al反应能放出大量H2的溶液中:Cl-、Na+、NO3-、Fe2+ | |
| D. | 由水电离出的c(OH-)=1×10-10mol.L-1的溶液中:Ba2+、K+、NO3-、Cl- |


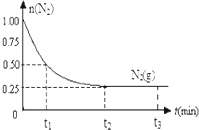 一定温度下,在体积为2L的恒容密闭容器中充入1mol N2和3mol H2,一定条件下发生反应:N2(g)+3H2(g)?2NH3(g),测得其中N2(g)物质的量随时间变化如图.
一定温度下,在体积为2L的恒容密闭容器中充入1mol N2和3mol H2,一定条件下发生反应:N2(g)+3H2(g)?2NH3(g),测得其中N2(g)物质的量随时间变化如图.