题目内容
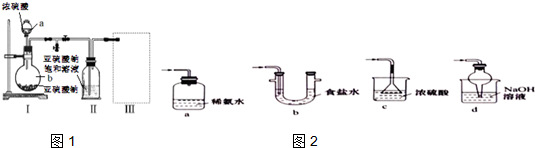
16.制备氮化镁的装置示意图如下,回答下列问题:
(1)a的名称是分液漏斗,b的名称是圆底烧瓶;
(2)写出NaNO2和(NH4)2 SO4反应制备氮气的化学方程式(NH4)2SO4+2NaNO2$\frac{\underline{\;\;△\;\;}}{\;}$2N2↑+Na2SO4+4H2O;
(3)C中硫酸亚铁溶液的作用是除去空气中的氧气,D中应盛放浓硫酸;
(4)已知氮化镁与水反应生成两种碱,设计实验检验生成的氮化镁中是否含有未反应的镁,写出实验操作及象取少量产物于试管中,加入少量蒸馏水,试管底部有沉淀生成,弃去上层清液,加入盐酸,若观察到有气泡产生,则证明产物中含有未反应的镁.
分析 由图可知仪器的名称,A中发生(NH4)2SO4+2NaNO2$\frac{\underline{\;\;△\;\;}}{\;}$2N2↑+Na2SO4+4H2O,C中硫酸亚铁溶液可除去空气中的氧气,D中浓硫酸干燥氮气,E中发生N2+3Mg$\frac{\underline{\;\;△\;\;}}{\;}$Mg3N2,F可防止倒吸,G中硫酸亚铁溶液可防止空气中的氧气进入E中,以此来解答.
解答 解:(1)仪器a的名称是分液漏斗,b的名称是圆底烧瓶,故答案为:分液漏斗;圆底烧瓶;
(2)NaNO2和(NH4)2SO4反应制备氮气的化学方程式为(NH4)2SO4+2NaNO2$\frac{\underline{\;\;△\;\;}}{\;}$2N2↑+Na2SO4+4H2O,
故答案为:(NH4)2SO4+2NaNO2$\frac{\underline{\;\;△\;\;}}{\;}$2N2↑+Na2SO4+4H2O;
(3)C的作用为除去空气中的氧气,防止Mg与氧气反应,D中浓硫酸干燥氮气,
故答案为:除去空气中的氧气;浓硫酸;
(4)因氮化镁与水反应,Mg不溶于水,但Mg与酸反应,则确定氮化镁是否含有未反应的镁,其实验操作及现象为取少量产物于试管中,加入少量蒸馏水,试管底部有沉淀生成,弃去上层清液,加入盐酸,若观察到有气泡产生,则证明产物中含有未反应的镁,
故答案为:取少量产物于试管中,加入少量蒸馏水,试管底部有沉淀生成,弃去上层清液,加入盐酸,若观察到有气泡产生,则证明产物中含有未反应的镁.
点评 本题考查物质的制备实验,为高频考点,把握实验装置的作用、发生的反应及制备原理为解答的关键,侧重分析与实验能力的考查,注意物质性质的综合应用,题目难度中等.

练习册系列答案
 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案
相关题目
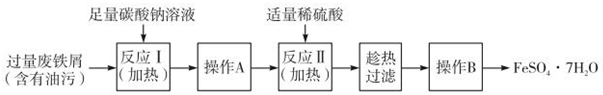
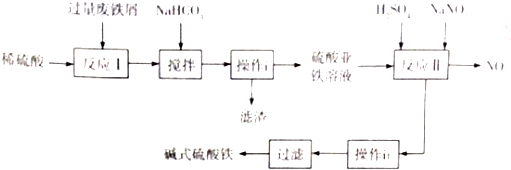
4.铁盐、铝盐可用来净水,近年来科技工作者开发出了一些新的净水剂,如碱式硫酸铁[Fe(OH)SO4]就是一种新型高效净水剂.下图是利用含少量Al2O3、Fe2O3等杂质的废铁屑,生产碱式硫酸铁的工艺流程:
已知:
回答下列问题:
(1)写出反应I中主反应的离子方程式:Fe+2H+═Fe2++H2↑.
(2)加入NaHCO3,调节溶液pH=4.4~5.5,目的是使A13+转化为沉淀除去.
(3)操作i的名称是过滤,滤渣的成分是Al(OH)3、Fe.
(4)反应II的氧化剂与还原剂的物质的最之比为1:1,该反应的还原产物的化学式为NO.
(5)Fe(OH)SO4溶于水后生成Fe(OH)2+,该离子部分水解,生成Fe2(OH)42+.该水解反应的离子方程式为2Fe(OH)2++2H2O?Fe2(OH)42++2H+.

已知:
| 沉淀物 | Fe(OH)3 | Fe(OH)3 | Al(OH)3 |
| 开始沉淀的pH | 2.3 | 7.5 | 3.4 |
| 完全沉淀的pH | 3.2 | 9.7 | 4.4 |
(1)写出反应I中主反应的离子方程式:Fe+2H+═Fe2++H2↑.
(2)加入NaHCO3,调节溶液pH=4.4~5.5,目的是使A13+转化为沉淀除去.
(3)操作i的名称是过滤,滤渣的成分是Al(OH)3、Fe.
(4)反应II的氧化剂与还原剂的物质的最之比为1:1,该反应的还原产物的化学式为NO.
(5)Fe(OH)SO4溶于水后生成Fe(OH)2+,该离子部分水解,生成Fe2(OH)42+.该水解反应的离子方程式为2Fe(OH)2++2H2O?Fe2(OH)42++2H+.
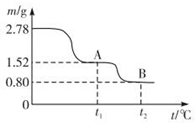
11.Na2SO3应用广泛.利用工业废碱渣(主要成分Na2CO3)吸收硫酸厂尾气中的SO2制备无水Na2SO3的成本低,优势明显,其流程如下.
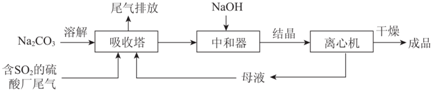
(1)举例说明向大气中排放SO2导致的环境问题:酸雨.
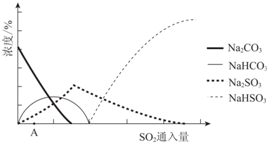
(2)如图为吸收塔中Na2CO3溶液与SO2反应过程中溶液组成变化.则初期反应(图中A点以前)的离子方程式是2CO32-+SO2+H2O=2HCO3-+SO32-.
(3)中和器中发生的主要反应的化学方程式是NaHSO3+NaOH=Na2SO3+H2O.
(4)为了降低由中和器所得溶液中Na2SO3的溶解度,从而提高结晶产率,中和器中加入的NaOH是过量的.
①请结合Na2SO3的溶解平衡解释NaOH过量的原因Na2SO3存在溶解平衡:Na2SO3(s)?2Na+ (aq)+SO32- (aq),NaOH过量使c(Na+)增大,上述平衡逆向移动.
②结晶时应选择的最佳操作是B(选填字母).
a.95~100℃加热蒸发,直至蒸干
B.维持95~100℃蒸发浓缩至有大量晶体析出
C.95~100℃加热浓缩,冷却至室温结晶
(5)为检验Na2SO3成品中是否含少量Na2SO4,需选用的试剂是稀盐酸、BaCl2溶液.
(6)KIO3滴定法可测定成品中Na2SO3的含量:室温下将0.1260g 成品溶于水并加入淀粉做指示剂,再用酸性KIO3标准溶液(x mol/L)进行滴定至溶液恰好由无色变为蓝色,消耗KIO3标准溶液体积为y mL.
①滴定终点前反应的离子方程式是:□IO3-+□SO32-=□3SO42-+□1I-(将方程式补充完整)
②成品中Na2SO3(M=126g/mol)的质量分数是3xy×100%.

(1)举例说明向大气中排放SO2导致的环境问题:酸雨.
(2)如图为吸收塔中Na2CO3溶液与SO2反应过程中溶液组成变化.则初期反应(图中A点以前)的离子方程式是2CO32-+SO2+H2O=2HCO3-+SO32-.

(3)中和器中发生的主要反应的化学方程式是NaHSO3+NaOH=Na2SO3+H2O.
| 资料显示: Ⅰ.Na2SO3在33℃时溶解度最大,将其饱和溶液加热至33℃以上时,由于溶解度降低会析出无水Na2SO3,冷却至33℃以下时析出Na2SO3•7H2O; Ⅱ.无水Na2SO3在空气中不易被氧化,Na2SO3•7H2O在空气中易被氧化. |
①请结合Na2SO3的溶解平衡解释NaOH过量的原因Na2SO3存在溶解平衡:Na2SO3(s)?2Na+ (aq)+SO32- (aq),NaOH过量使c(Na+)增大,上述平衡逆向移动.
②结晶时应选择的最佳操作是B(选填字母).
a.95~100℃加热蒸发,直至蒸干
B.维持95~100℃蒸发浓缩至有大量晶体析出
C.95~100℃加热浓缩,冷却至室温结晶
(5)为检验Na2SO3成品中是否含少量Na2SO4,需选用的试剂是稀盐酸、BaCl2溶液.
(6)KIO3滴定法可测定成品中Na2SO3的含量:室温下将0.1260g 成品溶于水并加入淀粉做指示剂,再用酸性KIO3标准溶液(x mol/L)进行滴定至溶液恰好由无色变为蓝色,消耗KIO3标准溶液体积为y mL.
①滴定终点前反应的离子方程式是:□IO3-+□SO32-=□3SO42-+□1I-(将方程式补充完整)
②成品中Na2SO3(M=126g/mol)的质量分数是3xy×100%.
8.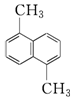 物质A的分子式为C12H12,结构简式为如图,已知苯环上的二溴代物有9种同分异构体,由此推测A的苯环上的四溴代物的异构体数目有( )
物质A的分子式为C12H12,结构简式为如图,已知苯环上的二溴代物有9种同分异构体,由此推测A的苯环上的四溴代物的异构体数目有( )
 物质A的分子式为C12H12,结构简式为如图,已知苯环上的二溴代物有9种同分异构体,由此推测A的苯环上的四溴代物的异构体数目有( )
物质A的分子式为C12H12,结构简式为如图,已知苯环上的二溴代物有9种同分异构体,由此推测A的苯环上的四溴代物的异构体数目有( )| A. | 9种 | B. | 10种 | C. | 11种 | D. | 12种 |
5.某固体物质只含有钠和氧两种元素,将它放在足量的水中反应产生两种气体,这两种气体又可以在一定条件下反应牛成水.则原固体物质的组成是( )
| A. | Na2O2与Na2O | B. | Na2O2 | C. | Na2O2与Na | D. | Na和Na2O |
4.某化学小组欲探究铁及其化合物的氧化性和还原性.请回答下列问题:
(1)请帮助他们完成以下实验报告:
实验目的:探究铁及其化合物的氧化性和还原性
试剂:铁粉、FeCl3溶液、FeCl2溶液、氯水、锌片、碘化钾、淀粉溶液
实验记录:
实验结论:Fe只有还原性;Fe3+只有氧化性;Fe2+既有氧化性,又有还原性.
(2)亚铁盐在溶液中易被氧化,而实验中需要纯净的亚铁盐溶液.那么保存亚铁盐溶液时如何防止亚铁盐被氧化加铁粉.
(3)检验某铁盐溶液中是否含有亚铁盐的方法是取少量溶液于试管中滴加1滴酸性KMnO4溶液,若紫色褪去,则有Fe2+.
(1)请帮助他们完成以下实验报告:
实验目的:探究铁及其化合物的氧化性和还原性
试剂:铁粉、FeCl3溶液、FeCl2溶液、氯水、锌片、碘化钾、淀粉溶液
实验记录:
| 序号 | 实验内容 | 实验现象 | 离子方程式 | 实验结论 |
| ① | 在FeCl2溶液中滴入适量氯水 | 溶液由浅绿色变为黄色 | 2Fe2++Cl2=2Fe3++2Cl- | Fe2+具有还原性 |
| ② | 在FeCl2溶液中加入锌片 | (不写) | Zn+Fe2+=Zn2++Fe | Fe2+具有氧化性 |
| ③ | 在FeCl3溶液中加入足量铁粉 | 溶液由黄色变为浅绿色 | Fe+2Fe3+=3Fe2+ | Fe3+具有氧化性 |
| ④ | 在FeCl3溶液中滴入适量KI溶液和淀粉溶液 | 变蓝色 | 2Fe3++2I-=2Fe2++I2 | Fe3+具有氧化性 |
(2)亚铁盐在溶液中易被氧化,而实验中需要纯净的亚铁盐溶液.那么保存亚铁盐溶液时如何防止亚铁盐被氧化加铁粉.
(3)检验某铁盐溶液中是否含有亚铁盐的方法是取少量溶液于试管中滴加1滴酸性KMnO4溶液,若紫色褪去,则有Fe2+.