题目内容
5.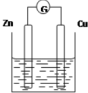 如图是以Zn和Cu为电极,稀H2SO4为电解质溶液形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下:
如图是以Zn和Cu为电极,稀H2SO4为电解质溶液形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下:实验后的记录:
①正极的电极反应式:Zn-2e-=Zn2+
②H+向负极移动
③电子流动方向Zn→Cu
④在Cu处产生1.12L H2,则电路中一定有0.1mol电子通过
(1)在卡片上,叙述合理的是③(填序号).
(2)在实验中,甲同学发现不仅在铜片上有气泡产生,而且在锌片上也产生了气体,原因可能是铜片不纯.
(3)如果把锌片换成石墨,发现电流计指针几乎不能偏转,原因是Cu和石墨都不与硫酸反应,不符合原电池形成条件.
分析 (1)Zn、Cu、稀硫酸构成原电池,锌易失电子作负极、Cu作正极,负极反应式为Zn-2e-=Zn2+、正极反应式为2H++2e-=H2↑,电子从负极沿导线流向正极,放电时,电解质溶液中阳离子向正极移动、阴离子向负极移动;
(2)在实验中,甲同学发现不仅在铜片上有气泡产生,而且在锌片上也产生了气体,原因可能是铜片不纯,本身上构成了许多微小的原电池;
(3)如果把锌片换成石墨,该装置不能自发进行氧化还原反应,所以不能构成原电池;
解答 解:(1)①负极的电极反应式:Zn-2e-=Zn2+,故错误;
②H+向正极移动,故错误;
③电子从负极流向正极,所以电子流动方向Zn→Cu,故正确;
④在Cu处产生1.12L H2,状态不知,无法由体积求物质的量,故错误;故答案为:③;
(2)在实验中,甲同学发现不仅在铜片上有气泡产生,而且在锌片上也产生了气体,原因可能是铜片不纯,本身上构成了许多微小的原电池,故答案为:铜片不纯;
(3)如果把锌片换成石墨,该装置不能自发进行氧化还原反应,所以不能构成原电池,所以没有电流产生,故答案为:Cu和石墨都不与硫酸反应,不符合原电池形成条件.
点评 本题考查了原电池原理,明确原电池构成条件、正负极上发生的反应即可解答,知道电子流向、电解质溶液中阴阳离子流动方向,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
15.下列说法错误的是( )
| A. | 石油中含有C5~C11的烷烃,可以通过石油的分馏得到汽油 | |
| B. | 含C18以上烷烃的重油经过催化裂化可以得到汽油 | |
| C. | 煤干馏和石油分馏本质差别是:干馏是化学变化而分馏是物理变化 | |
| D. | 煤中含有苯和甲苯,可以用先干馏后分馏的方法把它们分离出来 |
16.化学计量在化学中占有重要地位,请回答下列问题:
(1)在标准状况下,CO和CO2的混合气体共33.6L,质量为50g.
①两种气体总的物质的量为1.5mol.
②C与O原子个数比为3:4.
(2)实验室有一瓶失去标签的盐酸和一块镁铜合金,在0℃、1.01×105Pa时,分别向甲、乙、丙三个容器中加入100mL同浓度的盐酸后,再加入不同质量的同种粉末,得到的有关实验数据列于下表,请确定盐酸的浓度和合金的组成:
①下列的相关说法正确的是BC(填序号).
A.实验甲中,盐酸已完全反应
B.实验乙中,金属镁和盐酸恰好完全反应
C.若往实验丙的剩余物中添加盐酸,将继续产生氢气
D.金属铜参加反应并产生氢气
②盐酸的物质的量浓度4mol/L,合金中镁的质量分数27.3%.
(1)在标准状况下,CO和CO2的混合气体共33.6L,质量为50g.
①两种气体总的物质的量为1.5mol.
②C与O原子个数比为3:4.
(2)实验室有一瓶失去标签的盐酸和一块镁铜合金,在0℃、1.01×105Pa时,分别向甲、乙、丙三个容器中加入100mL同浓度的盐酸后,再加入不同质量的同种粉末,得到的有关实验数据列于下表,请确定盐酸的浓度和合金的组成:
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量/g | 8.8 | 17.6 | 22.0 |
| 气体体积/L | 2.24 | 4.48 | 4.48 |
A.实验甲中,盐酸已完全反应
B.实验乙中,金属镁和盐酸恰好完全反应
C.若往实验丙的剩余物中添加盐酸,将继续产生氢气
D.金属铜参加反应并产生氢气
②盐酸的物质的量浓度4mol/L,合金中镁的质量分数27.3%.
10.下列实验操作正确的是( )
| A. | 粗盐提纯蒸发时,待水分完全蒸干后停止加热 | |
| B. | 过滤时,漏斗下口尖端紧贴烧杯内壁 | |
| C. | 蒸馏时,冷却水应从冷凝管上口进下口出 | |
| D. | 分液操作时,上层液体应从分液漏斗下口放出 |
14.用NA表示阿伏加德罗常数,下列说法中正确的是( )
| A. | 12 g石墨和C60的混合物中质子总数为6NA | |
| B. | 常温下,4g 14CH4含有NA个C-H共价键 | |
| C. | 25℃时,pH=12的1.0 L NaClO溶液中水电离出的OH-的数目为0.01NA | |
| D. | 0.1 mol•L-1 Na2CO3溶液中含有0.1NA个CO32- |
6.下列说法错误的是( )
| A. | 从1L 1 mol•L-1的氯化钠溶液中取出10ml,其浓度仍是1 mol•L-1 | |
| B. | 物质的量是指物质所含微粒的数目 | |
| C. | 0.5 L 2 mol•L-1的氯化钡溶液中,钡离子和氯离子总数为3×6.02×1023 | |
| D. | 冰水混合物既是纯净物又是化合物 |
 氟在自然界中常以CaF2的形式存在.
氟在自然界中常以CaF2的形式存在.