题目内容
12.某课外小组利用H2还原CuO粉末测定铜元素的相对原子质量,如图是测定装置的示意图,A中的试剂是盐酸,C中试剂是稀氢氧化钠溶液.
请回答下列问题.
(1)仪器中装入的试剂:B锌粒、D浓硫酸.
(2)装置C的作用是除去氢气中混有的氯化氯气体.
(3)连接好装置后应首先检查气密性.
(4)“①加热反应管E”和“②从A瓶逐滴滴加液体”这两步操作应该先进行的是②(填序号).在这两步之间还应进行的操作是检验H2的纯度.
(5)反应过程中G管逸出的气体是氢气,其处理方法是在G管出口处点燃.
(6)从实验中测得了下列数据:
①空E管的质量a; ②E管和CuO的总质量b;
③反应后E管和Cu粉的总质量c(冷却到室温称量);
④反应前F管及内盛物的总质量d;⑤反应后F管及内盛物的总质量e.由以上数据可以列出计算Cu的相对原子质量的两个不同计算式(除Cu外,其他涉及的元素的相对原子质量均为已知):计算式1:Ar(Cu)=$\frac{16(c-a)}{b-c}$;计算式2:Ar(Cu )=$\frac{18(c-a)}{e-d}$.
分析 装置A中是盐酸,装置B中是锌粒反应生成氢气,通过氢氧化钠溶液除去挥发出的氯化氢气体,再通过浓硫酸干燥氢气,通过装置E还原氧化铜为铜,F的作用是防止空气中的二氧化碳、水蒸气进入装置E,G处检验装置中的氢气是否充满,
(1)根据实验室制取氢气的原理以及氢气的干燥知识来回答;
(2)装置C的作用是除去盐酸挥发出的氯化氢气体;
(3)气体发生装置和反应装置需要根据大气压强原理来检验装置的气密性;
(4)实验过程中要注意先将装置中的空气赶尽,再进行实验,并检验氢气的纯度是关键;
(5)根据实验装置原理和氢气的检验方法来回答;
(6)根据H2与cUO反应的化学方程式,要求Cu的相对原子质量,可以用固体的质量变化,也可以利用生成的H2O的质量求解.
解答 解:(1)实验室用金属锌和稀盐酸反应来获得氢气,氢气可以用浓硫酸干燥,
故答案为:锌粒;浓硫酸;
(2)分液漏斗中的因素是以挥发性酸,挥发出的氯化氢混入氢气,干扰后续实验,所以装置C的作用是利用氢氧化钠溶液除去挥发出的氯化氢气体,
故答案为:除去氢气中混有的氯化氯气体;
(3)实验装置连接好了以后,要检验装置的气密性,可以根据气压原理来检验,关闭分液漏斗上的活塞,将G弯管浸没在盛有水的烧杯中,温热烧瓶B,观察G管口,若有气泡逸出,停止加热后,导气管与烧杯中有液面差,一段时间内液面差保持不变,说明装置的气密性良好;
故答案为:检查气密性;
(4)实验过程中,在H2与WO3反应前必须依次除去氯化氢、水蒸气,装置中的空气赶尽,再进行实验,所以先从A瓶逐滴滴加液体,待氢气纯净后进行试验,
故答案为:②;检验H2的纯度;
(5)实验接收后,会用氢气剩余,保证金属氧化物全部消耗,所以最后出来的是氢气,点燃会出现淡蓝色的火焰,故答案为:氢气;在G管出口处点燃;
(5)CuO+H2 $\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O
Ar(Cu)+16 Ar(Cu) 18
b-c c-a e-d
即$\frac{Ar(Cu)+16}{b-c}$=$\frac{Ar(Cu)}{c-a}$
$\frac{Ar(Cu)}{c-a}$=$\frac{18}{e-d}$
分别求解,可求得Ar(Cu)=$\frac{16(c-a)}{b-c}$或Ar(W)=$\frac{18(c-a)}{e-d}$,
故答案为:$\frac{16(c-a)}{b-c}$,$\frac{18(c-a)}{e-d}$.
点评 本题主要考查了W元素的相对原子质量的测定,同时还考查了基本实验操作,综合性较强,难度较大,注意各个量代表的含义.

 如图是实验室用乙醇与浓硫酸和溴化钠反应来制备溴乙烷的装置,反应需要加热,图中省去了加热装置.有关数据见下表:
如图是实验室用乙醇与浓硫酸和溴化钠反应来制备溴乙烷的装置,反应需要加热,图中省去了加热装置.有关数据见下表:乙醇、溴乙烷、溴有关参数:
| 乙醇 | 溴乙烷 | 溴 | |
| 状态 | 无色液体 | 无色液体 | 深红棕色液体 |
| 密度/g•cm-3 | 0.79 | 1.44 | 3.1 |
| 沸点/℃ | 78.5 | 38.4 | 59 |
a.减少副产物烯和醚的生成 b.减少Br2的生成 c.减少HBr的挥发 d.水是反应的催化剂
(2)已知加热温度较低时NaBr与硫酸反应生成NaHSO4,写出加热时A中发生的主要反应的化学方程式CH3CH2OH+NaBr+H2SO4$\stackrel{△}{→}$NaHSO4+CH3CH2Br+H2O.
(3)仪器B的名称球形冷凝管,冷却水应从B的下(填“上”或“下”)口流进.
(4)反应生成的溴乙烷应在C中(填“A”或“C”中).
(5)若用浓的硫酸进行实验时,得到的溴乙烷呈棕黄色,最好选择下列c(选填序号)溶液来洗涤产品.
a.氢氧化钠 b.亚硫酸钠 c.碘化亚铁 d.碳酸氢钠
洗涤产品时所需要的玻璃仪器有分液漏斗、烧杯.
学习小组在进行1-氯丙烷与NaOH乙醇溶液的反应中,观察到有气体生成.
请你设计两种不同的方法分别检验该气体.在答题卡的方框中写出装置中所盛试剂的名称(试剂任选)和实验现象.
| 装置图 | 所盛试剂 | 实验现象 | |
| 1 | 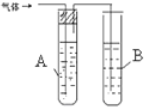 | A是 水 B是 酸性高锰酸钾溶液 | |
| 2 |  | C是 溴的四氯化碳溶液 |

| A. | 保持温度和活塞位置不变,在甲中再加入1 mol A和2 mol B,达到新的平衡后,甲中C的浓度是乙中C的浓度的2倍 | |
| B. | 保持活塞位置不变,升高温度,达到新的平衡后,甲中B的体积分数增大,乙中B的体积分数减小 | |
| C. | 保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍 | |
| D. | 保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省略) |

| A. | 理论上外电路中每转移1mol电子,负极消耗的质量为7g | |
| B. | 可以将Li+快离子导体更换成阳离子交换膜,去掉聚合物电解质直接使用Li2SO4水溶液 | |
| C. | 电池放电反应为 Li1-xMn2O4+xLi═LiMn2O4 | |
| D. | 放电时,溶液中的Li+从b向a迁移 |

 .
. .
. 系统命名法命名为5-甲基-4-乙基-3-庚烯
系统命名法命名为5-甲基-4-乙基-3-庚烯 系统命名法命名为1,3二甲基苯
系统命名法命名为1,3二甲基苯 .
. 丙烯酰胺是一种重要的有机合成的中间体.它的球棍模型如图所示:(图中“棍”代表单键或双键或三健,不同颜色球表示不同原子:C、H、O、N)
丙烯酰胺是一种重要的有机合成的中间体.它的球棍模型如图所示:(图中“棍”代表单键或双键或三健,不同颜色球表示不同原子:C、H、O、N) .
.