题目内容
将盛有1mol NO和NO2的混合气体的试管倒立于水槽中,再通入0.4mol O2,充分反应后,水便会充满整个试管.则原混合气体中NO与NO2体积比为( )
| A、1:2 | B、2:5 |
| C、3:7 | D、无法确定 |
考点:有关混合物反应的计算
专题:计算题
分析:发生的反应方程式为:4NO2+O2+2H2O═4HNO3,4NO+3O2+2H2O═4HNO3,通入0.4mol O2,反应后试管中充满溶液,则二氧化氮、NO恰好与0.4mol氧气反应,设出二者物质的量,然后根据二者总物质的量及氧气的物质的量列式计算即可.
解答:
解:设混合气体中含有xmolNO、ymolNO2,则:①x+y=1mol,
根据题干信息可知,1molNO和NO2的混合气体恰好与0.4mol氧气反应生成硝酸,
根据反应方程式4NO2+O2+2H2O═4HNO3、4NO+3O2+2H2O═4HNO3可知,
4 1 4 3
ymol
y xmol
x
则:②
y+
x=0.4mol,
根据①②解得:x=0.3、y=0.7,
相同条件下气体体积与物质的量成正比,
则原混合气体中NO与NO2体积比为0.3mol:0.7mol=3:7,
故选C.
根据题干信息可知,1molNO和NO2的混合气体恰好与0.4mol氧气反应生成硝酸,
根据反应方程式4NO2+O2+2H2O═4HNO3、4NO+3O2+2H2O═4HNO3可知,
4 1 4 3
ymol
| 1 |
| 4 |
| 3 |
| 4 |
则:②
| 1 |
| 4 |
| 3 |
| 4 |
根据①②解得:x=0.3、y=0.7,
相同条件下气体体积与物质的量成正比,
则原混合气体中NO与NO2体积比为0.3mol:0.7mol=3:7,
故选C.
点评:本题考查氮的氧化物性质、混合物反应的计算等,题目难度不大,明确二氧化氮、一氧化氮与氧气的反应原理为解答本题关键,试题培养了学生灵活应用所学知识的能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
用铂作电极电解1L含有0.4molCuSO4和0.2molNaCl的水溶液,一段时间后在一个电极上得到了0.3molCu,在另一极上析出的气体在标况下的体积是( )
| A、4.48L |
| B、5.6L |
| C、6.72L |
| D、13.44L |
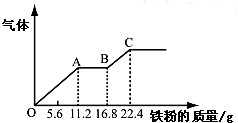 某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列分析或结果错误的是( )
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列分析或结果错误的是( )| A、原混合酸中NO3-物质的量为0.4 mol |
| B、原混合酸中H2SO4浓度为2.0 mol?L-1 |
| C、第二份溶液中最终溶质为FeSO4 |
| D、OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生氢气 |
下列说法正确的是( )
| A、SiO2是酸性氧化物,不与任何酸反应 |
| B、物质的量浓度相同的Na2SiO3和Na2CO3溶液,其PH值前者大于后者 |
| C、高温时SiO2和Na2CO3反应放出CO2,说明硅酸的酸性比碳酸强 |
| D、水玻璃敞口存放,会有沉淀析出 |
2011年在墨西哥召开的世界气候大会上,中国宣布了2020年中国单位GDP的二氧化碳排放量将比2005年下降40%~45%的减排目标,在这一目标的鼓舞下,低碳生活将逐渐成为时代的新时尚.下列不符合低碳生活理念的是( )
| A、把白炽灯换成节能灯 |
| B、利用太阳能和风能替代化石燃料 |
| C、鼓励购买小排量汽车,推广电动、混合动力汽车 |
| D、利用煤粉气化制备合成气技术,将煤变成合成气(一氧化碳及氢气总量≥90%) |
 如图所示,甲、乙均为容积1L的恒容容器,丙为恒压容器.
如图所示,甲、乙均为容积1L的恒容容器,丙为恒压容器.