题目内容
下列说法中,不正确的是( )
| A、碳酸氢钠在医疗上可用于治疗胃酸过多 |
| B、石灰石在工业上常用制造水泥和玻璃 |
| C、硅单质常用于制造太阳能电池和光纤 |
| D、氧化铝可用于制造耐高温的容器 |
考点:钠的重要化合物,硅和二氧化硅,水泥的主要化学成分、生产原料及其用途,两性氧化物和两性氢氧化物
专题:
分析:A.碳酸氢钠与胃液中的盐酸反应生成氯化钠、水和二氧化碳;
B.石灰石的主要成分是碳酸钙,高温下碳酸钙和二氧化硅能发生化学反应,石灰石在工业上常用制造水泥和玻璃;
C.太阳能电池的主要原料是硅,二氧化硅是光导纤维的主要原料;
D.氧化铝具有很高的熔点;
B.石灰石的主要成分是碳酸钙,高温下碳酸钙和二氧化硅能发生化学反应,石灰石在工业上常用制造水泥和玻璃;
C.太阳能电池的主要原料是硅,二氧化硅是光导纤维的主要原料;
D.氧化铝具有很高的熔点;
解答:
解:A.碳酸氢钠与胃液中的盐酸反应NaHCO3+HCl=NaCl+H2O+CO2↑,可用于治疗胃酸(主要成分是盐酸)过多,故A正确;
B.生产玻璃的原料是纯碱、石灰石和石英;制造水泥的原料是黏土和石灰石,故B正确;
C.硅是半导体材料,常用于制造太阳能电池,二氧化硅是光导纤维的主要原料,故C错误;
D.氧化铝具有很高的熔点,是一种比较好的耐火材料,可用于制造耐高温的容器,故D正确;
故选C.
B.生产玻璃的原料是纯碱、石灰石和石英;制造水泥的原料是黏土和石灰石,故B正确;
C.硅是半导体材料,常用于制造太阳能电池,二氧化硅是光导纤维的主要原料,故C错误;
D.氧化铝具有很高的熔点,是一种比较好的耐火材料,可用于制造耐高温的容器,故D正确;
故选C.
点评:本题考查了元素化合物的性质,掌握硅、生产玻璃、水泥的原料、抗酸药的反应原理、氧化铝的熔点即可解答,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
金属活动顺序表中氢前金属与酸溶液中的H+反应可生成H2.以下方法不能加快Fe与稀硫酸反应制取H2的速率的是( )
| A、用98%的浓硫酸代替稀硫酸制取H2 |
| B、适当加热反应体系 |
| C、用粉末状的铁代替块状或片状的铁 |
| D、加入几滴硫酸铜溶液 |
下列说法正确的是( )
| A、原子核外电子排布式为1s2的原子与原子核外电子排布式为1s22s2的原子化学性质相似 |
| B、Fe3+的最外层电子排布式为3s23p63d5 |
C、基态铜原子的最外层的电子排布图: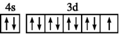 |
| D、所有非金属元素都分布在p区 |
下列各组离子在水溶液中因发生氧化还原反应而不能大量共存的是( )
| A、H+、K+、CO32-、HCO3- |
| B、Na+、Fe3+、Cl-、I- |
| C、K+、Al3+、NO3-、AlO2- |
| D、K+、Br-、HCO3-、CO32- |
氧化还原反应在生产、生活中具有广泛的用途.下列生产、生活中的事例中没有发生氧化还原反应的是( )
| A、燃放鞭炮 | B、配制生理盐水 |
| C、食物腐烂 | D、湿法炼铜 |
