题目内容
16.下列鉴别物质的方法能达到目的是( )| A. | 用Br2的CCl4溶液鉴别CH2=CH2和HC≡CH | |
| B. | 用AgNO3溶液鉴别KCl溶液和MgCl2溶液 | |
| C. | 用丁达尔效应鉴别Fe(OH)3胶体和FeCl3溶液 | |
| D. | 用酚酞溶液鉴别未知浓度的NaOH溶液和Na2CO3溶液 |
分析 A.CH2=CH2和HC≡CH都含不饱和键,与溴水发生加成反应;
B.KCl溶液和MgCl2溶液都可硝酸银反应生成沉淀;
C.胶体具有丁达尔效应;
D.NaOH溶液和Na2CO3溶液都呈碱性.
解答 解:A.CH2=CH2和HC≡CH都含不饱和键,与溴水发生加成反应,不能鉴别,故A错误;
B.KCl溶液和MgCl2溶液都可硝酸银反应生成沉淀,可用氢氧化钠鉴别,故B错误;
C.胶体具有丁达尔效应,可鉴别,故C正确;
D.NaOH溶液和Na2CO3溶液都呈碱性,不能鉴别,故D错误.
故选C.
点评 本题考查物质的检验和鉴别,涉及有机物的结构与性质及有机物的鉴别,为高频考点,把握官能团与性质的关系为解答的关键,侧重常见有机物性质的考查,题目难度不大.

练习册系列答案
 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案
相关题目
4.设NA为阿佛加德罗常数的值,下列说法正确的是( )
| A. | 常温常压下,18gH2O中含有的原子总数为3NA | |
| B. | 在标准状况下,22.4L Cl2完全溶于水转移的电子数目的为NA | |
| C. | 1L 0.1 mol•L-1 NaHCO3溶液中含有0.1NA个HCO3- | |
| D. | 常温下,pH=7的NaCl溶液中含有的OH-数目为10-7NA |
11.用含有A1203.SiO2和少量FeO•xFe2O3的铝灰制备A12(SO4)3•18H2O.工艺流程如下(部分操作和条件略):
Ⅰ.向铝灰中加入过量稀H2SO4,过滤:
Ⅱ.向滤液中加入过量KMnO4溶液,调节溶液的pH约为3;
Ⅲ.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色:
Ⅳ.加入MnSO4至紫红色消失,过滤;
Ⅴ.浓缩.结晶.分离,得到产品.
(1)H2S04溶解A1203的离子方程式是Al2O3+6H+=2Al3++3H2O
(2)KMnO4-氧化Fe2+的离子方程式补充完整:
1MnO4-+5Fe2++8H+=1Mn2++5Fe3++4H2O
(3)已知:
生成氢氧化物沉淀的pH
注:金属离子的起始浓度为0.1mol•L-1
根据表中数据解释步骤Ⅱ的目的:pH约为3时,Fe2+和Al3+不能形成沉淀,将Fe2+氧化为Fe3+,可使铁完全沉淀
(4)己知:一定条件下,MnO4-可与Mn2+反应生成MnO2,
①向Ⅲ的沉淀中加入浓HCI并加热,能说明沉淀中存在MnO2的现象是生成黄绿色气体.
②Ⅳ中加入MnS04的目的是除去过量的MnO4-.
Ⅰ.向铝灰中加入过量稀H2SO4,过滤:
Ⅱ.向滤液中加入过量KMnO4溶液,调节溶液的pH约为3;
Ⅲ.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色:
Ⅳ.加入MnSO4至紫红色消失,过滤;
Ⅴ.浓缩.结晶.分离,得到产品.
(1)H2S04溶解A1203的离子方程式是Al2O3+6H+=2Al3++3H2O
(2)KMnO4-氧化Fe2+的离子方程式补充完整:
1MnO4-+5Fe2++8H+=1Mn2++5Fe3++4H2O
(3)已知:
生成氢氧化物沉淀的pH
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
根据表中数据解释步骤Ⅱ的目的:pH约为3时,Fe2+和Al3+不能形成沉淀,将Fe2+氧化为Fe3+,可使铁完全沉淀
(4)己知:一定条件下,MnO4-可与Mn2+反应生成MnO2,
①向Ⅲ的沉淀中加入浓HCI并加热,能说明沉淀中存在MnO2的现象是生成黄绿色气体.
②Ⅳ中加入MnS04的目的是除去过量的MnO4-.
1.纯水在95℃和25℃时的pH( )
| A. | 前者大 | B. | 后者大 | C. | 相等 | D. | 无法确定 |
8.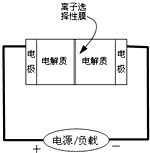 如图是一种正在投入生产的大型蓄电系统的原理图.电池中的左右两侧为电极,中间为离子选择性膜,在电池放电和充电时该膜只允许钠离子通过.电池充、放电的化学反应方程式为:2Na2S2+NaBr3$?_{放电}^{充电}$Na2S4+3NaBr.下列关于此电池说法正确的是( )
如图是一种正在投入生产的大型蓄电系统的原理图.电池中的左右两侧为电极,中间为离子选择性膜,在电池放电和充电时该膜只允许钠离子通过.电池充、放电的化学反应方程式为:2Na2S2+NaBr3$?_{放电}^{充电}$Na2S4+3NaBr.下列关于此电池说法正确的是( )
 如图是一种正在投入生产的大型蓄电系统的原理图.电池中的左右两侧为电极,中间为离子选择性膜,在电池放电和充电时该膜只允许钠离子通过.电池充、放电的化学反应方程式为:2Na2S2+NaBr3$?_{放电}^{充电}$Na2S4+3NaBr.下列关于此电池说法正确的是( )
如图是一种正在投入生产的大型蓄电系统的原理图.电池中的左右两侧为电极,中间为离子选择性膜,在电池放电和充电时该膜只允许钠离子通过.电池充、放电的化学反应方程式为:2Na2S2+NaBr3$?_{放电}^{充电}$Na2S4+3NaBr.下列关于此电池说法正确的是( )| A. | 充电的过程中当0.1molNa+通过离子交换膜时,导线通过0.2mol电子 | |
| B. | 放电过程中钠离子从右到左通过离子交换膜 | |
| C. | 电池放电时,负极反应为:3NaBr-2e-=NaBr3+2Na+ | |
| D. | 充电过程中钠离子从右到左通过离子交换膜 |
5.已知将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)═CO2(g)+3H2(g)△H=+49.0kJ/mol
②CH3OH(g)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g)△H=-192.9kJ/mol
下列说法正确的是( )
①CH3OH(g)+H2O(g)═CO2(g)+3H2(g)△H=+49.0kJ/mol
②CH3OH(g)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g)△H=-192.9kJ/mol
下列说法正确的是( )
| A. | CH3OH的燃烧热为192.9kJ/mol | |
| B. | 由上述原理可推知H2的燃烧热为241.9 kJ/mol | |
| C. | 反应②中的能量变化可用图表示: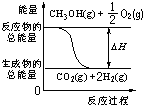 | |
| D. | CH3OH转变成H2的过程一定要吸收能量 |
6.反应A(g)+3B(g)?2C(g)△H<0,达平衡后,将反应体系的温度升高,下列叙述中正确的是( )
| A. | 逆反应速率增大更大,平衡向逆反应方向移动 | |
| B. | 正反应速率增大更大,平衡向正反应方向移动 | |
| C. | 正反应速率减小,逆反应速率增大,平衡向逆反应方向移动 | |
| D. | 正反应速率增大,逆反应速率减小,平衡向正反应方向移动 |