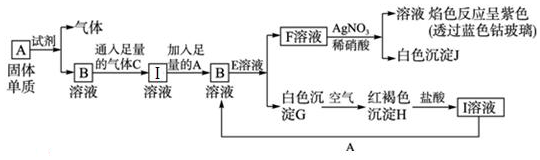
题目内容
3.(1)根据图1请写出合成氨的热化学方程式N2(g)+3H2(g)?2NH3(g)△H=-2(E3-E1)kJ/mol(热量用E1、E2或E3表示).(2)实验测得0.01mol/L的KMnO4的硫酸溶液和0.1mol/L的H2C2O4溶液等体积混合后,反应速率υ[mol/(L•s)]与反应时间t(s)的关系如图2所示.该反应的化学方程式为:2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O,回答如下问题:
①0→t2时间段内反应速率增大的原因是:反应中产生的Mn2+离子是此反应的催化剂,催化剂使反应速率增大的影响大于反应物浓度减小使反应速率减小的影响,
②t2→t时间段内反应速率减小的原因是:随着反应的进行,反应物浓度逐渐减小,成为影响反应速率的主要因素,从而反应速率减小,
③图中阴影部分“面积”表示t1→t3时间里AD.
A.Mn2+物质的量浓度的增大 B.Mn2+物质的量的增加
C.SO42-物质的量浓度 D.MnO4-物质的量浓度的减小.

分析 (1)由图1可知反应物的总能量大于生成物的总能量,则该反应为放热反应,生成1mol氨气时放出的热量为(E3-E1)kg,然后利用化学计量数与反应热的关系并标明物质的状态来书写热化学反应方程式;
(2)由图象可知,反应速率先增大后减小,随着反应的进行,反应物浓度逐渐减小,反应中锰离子为反应的催化剂,阴影面积为浓度的变化,以此解答该题.
解答 解:(1)由图可知该反应为放热反应,且生成1mol生成物放出的热量为(E3-E1)kg,则生成2mol生成物放热为2(E3-E1)kg,即该反应的热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-2(E3-E1)kg/mol,
故答案为:N2(g)+3H2(g)?2NH3(g)△H=-2(E3-E1) kJ/mol;
(2)①随着反应的进行,浓度逐渐减小,但速率增大,说明反应中产生的Mn2+离子是此反应的催化剂,催化剂使反应速率增大的影响大于反应物浓度减小使反应速率减小的影响,
故答案为:反应中产生的Mn2+离子是此反应的催化剂,催化剂使反应速率增大的影响大于反应物浓度减小使反应速率减小的影响;
②随着反应的进行,反应物的浓度降低,浓度越低,反应速率越小,所以浓度的改变是反应速率变化的主要原因,
故答案为:随着反应的进行,反应物浓度逐渐减小,成为影响反应速率的主要因素,从而反应速率减小;
③根据v=$\frac{△c}{△t}$,推倒得v×△t=△C,所以阴影面积表示反应物浓度的减少或生成物浓度的增加,故选AD.
点评 本题综合考查化学反应速率以及热化学方程式,为高频考点,侧重于学生的分析、计算能力的考查,注意把握图象的分析,难度不大.

练习册系列答案
相关题目
18.下列说法不正确的是( )
| A. | 淀粉和纤维素都可以在酸性条件下水解生成葡萄糖 | |
| B. | 煤的气化、液化和干馏都是煤综合利用的主要方法,都属于物理变化 | |
| C. | 地沟油发生皂化反应后加入饱和食盐水,搅拌发现液面上有固体物质 | |
| D. | 蛋白质溶液中加入浓的硫酸铵溶液,有固体析出 |
8.下列对于苯的化学性质的叙述中正确的是( )
| A. | 苯与溴水发生加成反应而使溴水褪色 | |
| B. | 苯与溴水发生取代反应而使溴水褪色 | |
| C. | 苯不能使酸性高锰酸钾溶液褪色 | |
| D. | 苯与浓硝酸、浓硫酸的混合物发生的反应不是取代反应 |
20.(Ⅰ)氨基甲酸铵(NH2COONH4)的制备氨基甲酸铵是一种白色固体,易分解、易水解,难溶于CCl4.可用做肥料.
制备氨基甲酸铵的装置如图1所示.反应的化学方程式如下:2NH3(g)+CO2(g)?NH2COONH4(s)△H<0.

注:四氯化碳与液体石蜡均为惰性介质.
(1)发生器用冰水冷却的原因是降低温度,防止因反应放热造成产物分解.提高反应物转化率.
(2)液体石蜡鼓泡瓶的作用是通过观察气泡,调节NH3与CO2通入比例.
(3)从反应后的混合物中分离出产品的实验方法是过滤(填写操作名称).为了得到干燥产品,应采取的方法是c(填写选项序号).
a.80℃热风下烘干 b.60℃热风下烘干 c.40℃热风下烘干
(4)尾气处理装置如图2所示.双通玻璃管的作用:防止倒吸;
浓硫酸的作用:吸收多余氨气、防止空气中水蒸气进入反应器使氨基甲酸铵水解.
(5)取因部分变质而混有碳酸氢铵的氨基甲酸铵样品0.7820g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为1.000g.则样品中氨基甲酸铵的物质的量分数为80%.(精确到2位小数,碳酸氢铵和氨基甲酸铵的相对分子质量分别为79和78)
(Ⅱ) FeSO4•7H2O晶体的制备
(6)已知:
某研究性学习小组欲从硫铁矿烧渣(主要成分为Fe2O3、SiO2、Al2O3)出发,制备绿矾(FeSO4•7H2O),补充完整由硫铁矿烧渣制备FeSO4•7H2O晶体的实验步骤(可选用的试剂:铁粉、稀硫酸和NaOH溶液):
①向一定量烧渣中加入足量的稀硫酸充分反应,充分反应后过滤,
②向滤液加入足量的铁粉,充分搅拌后,过滤,
③滤液中滴加NaOH溶液调节反应液的pH约为5.0~5.8,过滤,
④将得到溶液加热蒸发浓缩,冷却结晶,过滤,洗涤,低温干燥,得到FeSO4•7H2O晶体.
制备氨基甲酸铵的装置如图1所示.反应的化学方程式如下:2NH3(g)+CO2(g)?NH2COONH4(s)△H<0.

注:四氯化碳与液体石蜡均为惰性介质.
(1)发生器用冰水冷却的原因是降低温度,防止因反应放热造成产物分解.提高反应物转化率.
(2)液体石蜡鼓泡瓶的作用是通过观察气泡,调节NH3与CO2通入比例.
(3)从反应后的混合物中分离出产品的实验方法是过滤(填写操作名称).为了得到干燥产品,应采取的方法是c(填写选项序号).
a.80℃热风下烘干 b.60℃热风下烘干 c.40℃热风下烘干
(4)尾气处理装置如图2所示.双通玻璃管的作用:防止倒吸;
浓硫酸的作用:吸收多余氨气、防止空气中水蒸气进入反应器使氨基甲酸铵水解.
(5)取因部分变质而混有碳酸氢铵的氨基甲酸铵样品0.7820g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为1.000g.则样品中氨基甲酸铵的物质的量分数为80%.(精确到2位小数,碳酸氢铵和氨基甲酸铵的相对分子质量分别为79和78)
(Ⅱ) FeSO4•7H2O晶体的制备
(6)已知:
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Fe2+ | 5.8 | 8.8 |
①向一定量烧渣中加入足量的稀硫酸充分反应,充分反应后过滤,
②向滤液加入足量的铁粉,充分搅拌后,过滤,
③滤液中滴加NaOH溶液调节反应液的pH约为5.0~5.8,过滤,
④将得到溶液加热蒸发浓缩,冷却结晶,过滤,洗涤,低温干燥,得到FeSO4•7H2O晶体.
1.下列有关物质的分类正确的是( )
| A. | 纯净物:水银、氢氧化铁固体、冰水混合物 | |
| B. | 碱性氧化物:Na2O、Na2O2、Al2O3 | |
| C. | 盐:纯碱、小苏打、烧碱 | |
| D. | 电解质:CH3COOH、H2O、NH3 |
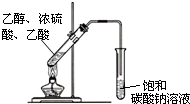 以乙烯为原料,可以制备乙酸乙酯
以乙烯为原料,可以制备乙酸乙酯
 与铬同周期的所有元素的基态原子中最外层电子数与铬原子相同的元素有K、Cu(填元素符号),其中一种金属的晶胞结构如图1所示,该晶胞中含有金属原子的数目为4.
与铬同周期的所有元素的基态原子中最外层电子数与铬原子相同的元素有K、Cu(填元素符号),其中一种金属的晶胞结构如图1所示,该晶胞中含有金属原子的数目为4.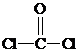 ,其中碳氧原子之间共价键是c(填序号)
,其中碳氧原子之间共价键是c(填序号)