题目内容
1. 某校研究小组欲研究外界条件对H2O2分解反应速率的影响,设计的实验方案如下表,并测量收集V mL气体所需的时间:
某校研究小组欲研究外界条件对H2O2分解反应速率的影响,设计的实验方案如下表,并测量收集V mL气体所需的时间:| 实验序号 | 5%H2O2溶液 | 水 | 溶液温度 | 1mol/L FeCl3溶液 | 所用时间 |
| ① | 10.0ml | 0.0ml | 20℃ | 2滴 | t1 |
| ② | 9.0ml | 1.0ml | 40℃ | 2滴 | t2 |
| ③ | 5.0ml | Vx ml | 20℃ | 2滴 | t3 |
| ④ | 9.0ml | 1.0ml | 40℃ | 0 | t4 |
| ⑤ | 9.0ml | 1.0ml | 20℃ | 2滴 | t5 |
(2)如果研究催化剂对化学反应速率的影响,使用实验②和④(用实验序号表示,下同);如果研究温度对化学反应速率的影响,使用实验②和⑤.
(3)若表中Vx=5ml,可利用实验①和实验③研究反应物浓度对化学反应速率的影响,且t1<t3(填“>”、“<”或“=”),理由是在其他条件相同时,实验①的反应物浓度大于实验③的反应物浓度,所以实验①的反应速率大于实验③的反应速率.
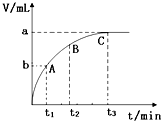
(4)某同学在50mL H2O2 溶液中加入一定量的二氧化锰,放出气体的体积(标准状况)与反应时间的关系如图所示,则0-t1、t1-t2、t2-t3三段所表示的反应速率最慢的是t2-t3.
分析 (1)过氧化氢分解生成水和氧气;
(2)研究催化剂对化学反应速率的影响,要让浓度、温度等条件相同;研究温度对化学反应速率的影响,要让催化剂、浓度等条件相同;
(3)根据其他条件一样,双氧水的浓度不同可进行浓度对速率影响的探究;
(4)根据速率的表示方法和图象横坐标和纵坐标的意义解答.
解答 解:(1)过氧化氢分解的化学方程式为:2H2O2 $\frac{\underline{\;三氯化铁\;}}{\;}$ 2H2O+O2↑,
故答案为:2H2O2 $\frac{\underline{\;三氯化铁\;}}{\;}$ 2H2O+O2↑;
(2)研究催化剂对化学反应速率的影响,要让浓度、温度等条件相同,这样的实验有②④;研究温度对化学反应速率的影响,要让催化剂、浓度等条件相同,这样的实验有②⑤,
故答案为:②④;②⑤;
(3)若表中Vx=5ml时,实验①和实验③的其他条件一样,只有双氧水的浓度不同,可进行浓度对速率影响的探究,实验①双氧水的浓度大,反应速率快,所用时间短,
故答案为:反应物浓度;在其他<;条件相同时,实验①的反应物浓度大于实验③的反应物浓度,所以实验①的反应速率大于实验③的反应速率;
(4)该图象横坐标表示时间,纵坐标表示生成气体的体积,时间越短生成的气体越多,反应速率越快,所以速率最慢的为t2-t3,
故答案为:t2-t3.
点评 本题考查探究外界条件对反应速率的影响,题目难度中等,注意设计对照实验时,其它条件必须相同,只有一个条件不同时才能得出正确结论,熟练掌握温度、浓度、催化剂等条件对反应速率的影响为解答关键.

练习册系列答案
相关题目
3.下列关于金属腐蚀与防护的说法不正确的是( )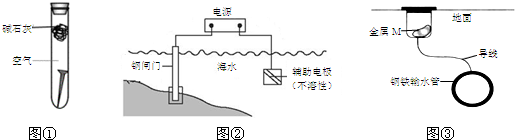

| A. | 图①,放置于干燥空气中的铁钉不会生锈 | |
| B. | 图②,若断开电源,钢闸门将发生吸氧腐蚀 | |
| C. | 图②,若将钢闸门与电源的正极相连,可防止钢闸门腐蚀 | |
| D. | 图③,若金属M比Fe活泼,可防止输水管腐蚀 |
4.下列实验操作正确的是( )


| A. | 中和滴定时,锥形瓶先用蒸馏水润洗,再用待测液润洗 | |
| B. | 检验某溶液中含有Na+无K+时,用洁净的铂丝蘸取该溶液,灼烧,观察火焰颜色 | |
| C. | 用图1所示装置,将Cl2和HCl的混合气体通过饱和NHCO3溶液,除去Cl2中HCl | |
| D. | 用图2所示装置,向含有少量水的乙醇中加入足量生石灰,蒸馏,得到无水乙醇 |
1.下列根据实验现象得出的结论正确的是( )
| A. | 将Fe(NO3)2样品溶于稀硫酸,滴入KSCN溶液,溶液变红色,则样品已变质 | |
| B. | NaBr溶液中滴入少量氯水和CCl4,震荡,有机相呈橙色,则还原性:Br->Cl- | |
| C. | 某试液中滴入BaCl2溶液和稀硝酸有白色沉淀,则试液中一定含SO42-或SO32- | |
| D. | 溴乙烷与NaOH的乙醇溶液共热,逸出的蒸气直接通入酸性高锰酸钾溶液,溶液紫色褪去,则逸出的蒸气一定为纯净的乙烯 |
8.下列每小题最后的物质是要制取的,其中合理的是( )
| A. | Al2O3$\stackrel{盐酸}{→}$AlCl3溶液$\stackrel{蒸发}{→}$AlCl3 | |
| B. | Cu$\stackrel{稀硫酸}{→}$CuSO4溶液$\stackrel{冷却结晶}{→}$CuSO4•5H2O | |
| C. | Fe$\stackrel{Cl_{2}}{→}$FeCl3$\stackrel{NaOH}{→}$Fe(OH)3$\stackrel{△}{→}$Fe2O3 | |
| D. | Mg$\stackrel{空气中燃烧}{→}$MgO$\stackrel{HCl}{→}$MgCl2溶液$\stackrel{蒸发}{→}$MgCl2 |
6.某实验小组对影响铝与盐酸反应的快慢的因素进行探究.下表是实验记录的数据.
(1)写出铝与盐酸反应的离子方程式:2Al+6H+=2Al3++3H2↑;
(2)实验①与实验②探究浓度对反应速率的影响,实验②与实验③探究温度对反应速率的影响.请将表中空白处填写完整,由实验得出的结论是:其他条件不变时,反应物浓度越大,反应速率越快,反应温度越高,反应速率越快.
(3)若实验④盐酸浓度为0.4mol/L,反应温度为40℃,铝片消失的时间大约为6.25s.实验⑤盐酸浓度为0.2mol/L,温度为50℃,铝片消失的时间与实验④相比可能更短的是⑤(填编号)
| 实验编号 | 盐酸的浓度 | 反应温度 | 铝片消失的时间 |
| ① | 0.1mol/L | 20℃ | 400s |
| ② | 0.2mol/L | 20℃ | 200s |
| ③ | 0.2mol/L | 30℃ | 50s |
(2)实验①与实验②探究浓度对反应速率的影响,实验②与实验③探究温度对反应速率的影响.请将表中空白处填写完整,由实验得出的结论是:其他条件不变时,反应物浓度越大,反应速率越快,反应温度越高,反应速率越快.
(3)若实验④盐酸浓度为0.4mol/L,反应温度为40℃,铝片消失的时间大约为6.25s.实验⑤盐酸浓度为0.2mol/L,温度为50℃,铝片消失的时间与实验④相比可能更短的是⑤(填编号)
13.下列化合物中能量最低的是( )
| A. | HF | B. | H20 | C. | H2S | D. | CH4 |
10.一种信息素的结构简式为CH3(CH2)5CH═CH(CH2)9CHO,关于检验该信息素中官能团的试剂和顺序,下列说法正确的是( )
| A. | 先加入溴水;后加酸性高锰酸钾溶液 | |
| B. | 先加入银氨溶液;再另取该物质加入溴水 | |
| C. | 先加入酸性高锰酸钾溶液;后加银氨溶液,水浴加热 | |
| D. | 先加入新制氢氧化铜悬浊液,加热;酸化后再加入溴水 |
 .
.