题目内容
工业上用氮气和氢气合成氨:N2+3H2
2NH3(反应放热),从反应速率和化学平衡两方面看,合成氨的适宜条件一般为压强:20MPa-50MPa,温度:500℃左右,催化剂:铁触媒.下列有关合成氨工业的叙述不正确的是( )
| 催化剂 |
| 高温高压 |
| A、使用铁触媒,可使氮气和氢气混合气体之间的反应在较低温度下取得较高的反应速率 |
| B、工业上选择上述条件下合成氨,可以使氮气全部转化为氨 |
| C、上述化学平衡的移动受到温度、反应物的浓度、压强等因素的影响 |
| D、温度升高,不利于氮气的转化率 |
考点:工业合成氨
专题:化学平衡专题
分析:A、铁触媒是催化剂,能使氮气和氢气在较低温度下反应,提高化学反应速率;
B、由于工业合成氨是可逆反应,氮气不能全部转化为氨;
C、合成氨是有气体参与的放热反应,所以平衡的移动受到温度、反应物的浓度、压强等因素的影响;
D、合成氨是放热反应,温度升高,不利于氮气的转化率.
B、由于工业合成氨是可逆反应,氮气不能全部转化为氨;
C、合成氨是有气体参与的放热反应,所以平衡的移动受到温度、反应物的浓度、压强等因素的影响;
D、合成氨是放热反应,温度升高,不利于氮气的转化率.
解答:
解:A、铁触媒是催化剂,能使氮气和氢气在较低温度下反应,提高化学反应速率,故A正确;
B、由于工业合成氨是可逆反应,氮气不能全部转化为氨,故B错误;
C、合成氨是有气体参与的放热反应,所以平衡的移动受到温度、反应物的浓度、压强等因素的影响,故C正确;
D、合成氨是放热反应,所以低温有利,温度升高,不利于氮气的转化率,故D正确;
故选B.
B、由于工业合成氨是可逆反应,氮气不能全部转化为氨,故B错误;
C、合成氨是有气体参与的放热反应,所以平衡的移动受到温度、反应物的浓度、压强等因素的影响,故C正确;
D、合成氨是放热反应,所以低温有利,温度升高,不利于氮气的转化率,故D正确;
故选B.
点评:本题考查了合成氨的原理,同时考查了外界条件对化学平衡的影响,比较基础,注意理解温度、浓度、压强、催化剂等外界条件对化学平衡的影响.

练习册系列答案
相关题目
空气质量指数(AQI)是定量评价空气质量状况的重要指标.下列物质中不属于评价空气质量的污染物是( )
| A、PM2.5 |
| B、CO2 |
| C、SO2 |
| D、O3 |
用NA表示阿伏加德罗常数的值.下列叙述中不正确的是( )
| A、足量Zn与一定量的浓硫酸反应,产生22.4L(标况)气体时,转移的电子数为2NA |
| B、一定条件下,32gO2和足量的铁粉充分反应,转移的电子数为4NA |
| C、4.6g乙醇和甲酸(HCOOH)的混合物中含有的碳原子数在0.1NA-0.2NA之间 |
| D、分子总数为NA的NO和NH3混合气体中含有的氮原子数为2NA |
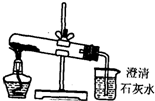 设计下列实验方案鉴别Na2CO3和NaHCO3两种白色粉末,难以达到预期目的是( )
设计下列实验方案鉴别Na2CO3和NaHCO3两种白色粉末,难以达到预期目的是( )| A、分别向等量的白色粉末中加等体积、等浓度的稀盐酸,比较生成气体的快慢 |
| B、分别将等量的白色粉末配成溶液,然后加入BaCl2溶液,看是否有沉淀生成 |
| C、分别将等量的白色粉末配成溶液,然后加入澄清石灰水,看是否有沉淀生成 |
| D、分别将等量的白色粉末用图中装置进行实验,比较澄清石灰水是否变混浊 |
配制一定物质的量浓度的NaOH溶液时,造成实验结果偏低的原因是( )
| A、容量瓶中原有少量蒸馏水 |
| B、称量药品时间过长 |
| C、定容时俯视液面 |
| D、洗涤烧杯和玻棒的溶液转入容量瓶中 |