题目内容
用NA表示阿伏加德罗常数的值.下列叙述中不正确的是( )
| A、足量Zn与一定量的浓硫酸反应,产生22.4L(标况)气体时,转移的电子数为2NA |
| B、一定条件下,32gO2和足量的铁粉充分反应,转移的电子数为4NA |
| C、4.6g乙醇和甲酸(HCOOH)的混合物中含有的碳原子数在0.1NA-0.2NA之间 |
| D、分子总数为NA的NO和NH3混合气体中含有的氮原子数为2NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A、足量Zn与一定量的浓硫酸反应,浓硫酸产生二氧化硫,变稀后产生氢气,分析两种情况下产生气体的物质的量和转移电子数的关系.
B、根据n=
并结合反应后氧元素的价态来分析;
C、根据乙醇和甲酸的摩尔质量均为46g/mol来计算;
D、根据NO和NH3中均只含一个氮原子来分析.
B、根据n=
| m |
| M |
C、根据乙醇和甲酸的摩尔质量均为46g/mol来计算;
D、根据NO和NH3中均只含一个氮原子来分析.
解答:
解:A、浓硫酸与锌反应产生气体为二氧化硫,每生成1molSO2转移2mol电子,稀硫酸与锌反应产生氢气,每生成1molH2转移2mol电子,标况下,22.4L气体的物质的量为1mol,故足量Zn与一定量的浓硫酸反应,产生22.4L(标况)气体时,转移的电子数为2NA,故A正确;
B、氧气的物质的量n=
=
=1mol,反应后氧元素变为-2价,故1mol氧气转移4mol电子,故B正确;
C、乙醇和甲酸的摩尔质量均为46g/mol,故乙醇和甲酸的混合物的物质的量为0.1mol,而若此0.1mol全为乙醇,则含有的碳原子的个数为0.2NA,若全为甲酸,含有的碳原子数为0.1NA,而现在是乙醇和甲酸的混合物,故碳原子数在0.1NA-0.2NA之间,故C正确;
D、分子总数为NA的NO和NH3混合气体的物质的量为1mol,而NO和NH3中均只含一个氮原子,故混合物中含有的氮原子的个数为NA,故D错误.
故选D.
B、氧气的物质的量n=
| m |
| M |
| 32g |
| 32g/mol |
C、乙醇和甲酸的摩尔质量均为46g/mol,故乙醇和甲酸的混合物的物质的量为0.1mol,而若此0.1mol全为乙醇,则含有的碳原子的个数为0.2NA,若全为甲酸,含有的碳原子数为0.1NA,而现在是乙醇和甲酸的混合物,故碳原子数在0.1NA-0.2NA之间,故C正确;
D、分子总数为NA的NO和NH3混合气体的物质的量为1mol,而NO和NH3中均只含一个氮原子,故混合物中含有的氮原子的个数为NA,故D错误.
故选D.
点评:本题考查了阿伏伽德罗常数的有关计算,掌握公式的使用和物质的结构、状态是解题关键,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
已知硫酸铅难溶于水,也难溶于硝酸,但可溶于醋酸铵(CH3COONH4)溶液形成无色溶液,其化学方程式为:PbSO4+2CH3COONH4=(CH3COO)2 Pb+(NH4)2SO4.当在(CH3COO)2 Pb溶液中通入H2S时,有黑色PbS生成.表示这个反应的有关离子方程式正确的是( )
| A、(CH3COO)2 Pb+H2S=PbS↓+2 CH3COOH |
| B、Pb2++H2S=PbS↓+2H+ |
| C、Pb2++2 CH3COO-+H2S=PbS↓+2 CH3COOH |
| D、Pb2++2 CH3COO-+2H++S2-=PbS↓+2 CH3COOH |
化合物HIn在水溶液中因存在以下电离平衡,故可用作酸碱指示剂,
HIn(溶液)?H+(溶液)+In-(溶液)
红色 黄色
浓度为0.02mol/L的下列溶液 ①石灰水 ②盐酸 ③NaCl溶液 ④NaHSO4溶液 ⑤氨水,其中能使指示剂变红的是( )
HIn(溶液)?H+(溶液)+In-(溶液)
红色 黄色
浓度为0.02mol/L的下列溶液 ①石灰水 ②盐酸 ③NaCl溶液 ④NaHSO4溶液 ⑤氨水,其中能使指示剂变红的是( )
| A、①⑤ | B、②④ | C、②④⑤ | D、①④ |
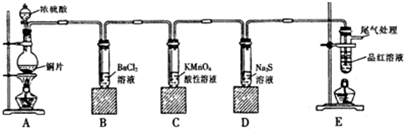
利用下列各组物质制备和收集相应的气体,可采用如图所示装置(图中尾气处理装置略)的是( )①石灰石和稀盐酸;②二氧化锰和浓盐酸;③铜和稀硝酸;④铜和浓硫酸;⑤双氧水和二氧化锰;⑥铝和烧碱溶液.

| A、①③ | B、①⑤ | C、④⑤ | D、⑤⑥ |
工业上用氮气和氢气合成氨:N2+3H2
2NH3(反应放热),从反应速率和化学平衡两方面看,合成氨的适宜条件一般为压强:20MPa-50MPa,温度:500℃左右,催化剂:铁触媒.下列有关合成氨工业的叙述不正确的是( )
| 催化剂 |
| 高温高压 |
| A、使用铁触媒,可使氮气和氢气混合气体之间的反应在较低温度下取得较高的反应速率 |
| B、工业上选择上述条件下合成氨,可以使氮气全部转化为氨 |
| C、上述化学平衡的移动受到温度、反应物的浓度、压强等因素的影响 |
| D、温度升高,不利于氮气的转化率 |
如表所示,提纯下列物质(括号内为杂质),所用除杂试剂和分离方法都正确的是( )
| 序号 | 不纯物 | 除杂试剂 | 分离方法 |
| A | CH4(C2H4) | 酸性KMnO4溶液 | 洗气 |
| B | 苯(苯酚) | 溴水 | 过滤 |
| C | 乙酸乙酯(乙酸) | NaOH溶液 | 蒸馏 |
| D | KNO3(NaCl) | 水 | 重结晶 |
| A、A | B、B | C、C | D、D |
八角茴香含有一种抗禽流感病毒的重要成分-莽草酸,其结构为: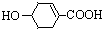 ,则莽草酸
,则莽草酸
不具有的性质是( )
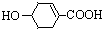 ,则莽草酸
,则莽草酸不具有的性质是( )
| A、遇FeCl3溶液呈紫色 |
| B、能发生消去反应 |
| C、能与H2发生加成反应 |
| D、1 mol莽草酸只能与1 mol NaOH反应 |