题目内容
19.短周期六元素A、B、C、D、E、F,原子序数依次增大;A、B的阴离子与C、D 的阳离子的电子排布式均为ls22s22p6,A原子核外有2个未成对电子,C单质可与热水反应但不能与冷水反应;E、F原子在基态时填充电子的轨道有9个,且E原子核外有3个未成对电子,F能与A形成相同价态的阴离子,且A离子半径小于F离子.回答:(1)C元素原子的第一电离能>(填“>”、“<”、“=”)D,理由是Mg原子最外层3s轨道处于全满,3p轨道处于全空,是相对稳定的结构.
(2)上述六种元素按电负性从小到大的排列是Mg<Al<P<S<O<F.(填元素符号)
(3)C、D、E、F元素形成的最高价氧化物中MgO、Al2O3(填化学式)是离子化合物,P2O5、SO3(填化学式)是共价化合物.
(4)上述元素的最高价氧化物对应水化物的酸性由强到弱的排列是:H2SO4>H3PO4>Al(OH)3>Mg(OH)2.(填化学式)
分析 原子序数依次增大的短周期元素A、B、C、D、E、F,A、B的阴离子与C、D的阳离子的电子排布式均为ls22s22p6,A原子核外有2个未成对电子,则A为O,B为F;C单质可与热水反应但不能与冷水反应,则C为Mg,D为Al,E、F原子在基态时填充电子的轨道有9个,且E原子核外有3个未成对电子,则E为P;F能与A形成相同价态的阴离子,且A离子半径小于F离子,则F和O同主族,且在O的下方,故为S,综上所述:A为氧,B为氟,C为镁,D为铝,E为磷,F为硫,据此进行答题.
解答 解:原子序数依次增大的短周期元素A、B、C、D、E、F,A、B的阴离子与C、D的阳离子的电子排布式均为ls22s22p6,A原子核外有2个未成对电子,则A为O,B为F,C单质可与热水反应但不能与冷水反应,则C为Mg,D为Al,E、F原子在基态时填充电子的轨道有9个,且E原子核外有3个未成对电子,则E为P,F能与A形成相同价态的阴离子,且A离子半径小于F离子,则F和O同主族,且在O的下方,故为S,综上所述:A为氧,B为氟,C为镁,D为铝,E为磷,F为硫,
(1)原子的轨道处于全满或处于全空时,是相对稳定的结构,Mg原子最外层3s轨道处于全满,3p轨道处于全空,
故答案为:>;Mg原子最外层3s轨道处于全满,3p轨道处于全空,是相对稳定的结构;
(2)同主族元素的原子电负性从上到下逐渐减小,同一周期元素原子的电负性从左到右逐渐增大,所以六原子的电负性顺序是:Mg<Al<P<S<O<F,
故答案为:Mg<Al<P<S<O<F;
(3)活泼金属氧化物大多是离子化合物,非金属氧化物大多是共价化合物,则MgO、Al2O3为离子化合物,P2O5、SO3为共价化合物,
故答案为:MgO、Al2O3;P2O5、SO3;
(4)从上到下逐渐减弱,同一周期元素的最高价氧化物对应水化物的酸性左到右逐渐增强,所以酸性顺序是:H2SO4>H3PO4>Al(OH)3>Mg(OH)2,
故答案为:H2SO4>H3PO4>Al(OH)3>Mg(OH)2.
点评 本题主要考查了位置、结构与性质关系的综合应用,题目难度中等,元素推断是解题的关键,试题知识点较多、综合性较强,充分考查学生的分析能力及灵活应用能力,注意熟练掌握元素周期表结构、元素周期律内容.

| A. | 石油分馏可以获得乙烯 | |
| B. | 煤经过气化和液化等物理变化可转化为淸洁燃料 | |
| C. | 聚乙烯塑料制品可用于食品包装 | |
| D. | 天然气和液化气的主要成分都是甲烷 |
①原子半径M<N;②离子半径M>N;③原子序数M>N;④原子最外层电子数M<N;⑤M的正价与N的负价绝对值一定相等;⑥元素所在的周期数:M>N;⑦元素的非金属性:M>N.
其中正确的组合是( )
| A. | ①②⑦ | B. | ③④⑤⑥⑦ | C. | ③⑤ | D. | ③④⑥ |
| A. | 原混合溶液中c(Na+)=6 mol | |
| B. | 电解后得到的Cu的物质的量为2 mol | |
| C. | 上述电解过程中共转移8 mol电子 | |
| D. | 电解后溶液中c(H+)=4 mol/L |
| A. | 不含OH-的溶液 | B. | 使酚酞试剂呈无色的溶液 | ||
| C. | pH=7的溶液 | D. | c(H+)=$\sqrt{{K}_{w}}$的溶液 |
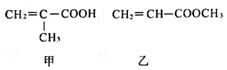
| A. | 甲与乙互为同分异构体 | |
| B. | 甲与乙都能与溴的四氯化碳溶液发生加成反应 | |
| C. | 甲与乙都能与金属钠反应产生氢气 | |
| D. | 在一定条件下,甲与乙均能发生取代反应 |
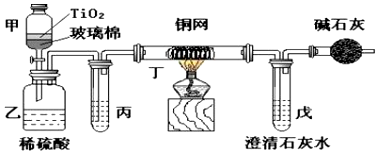
| A. | 通过石灰水 | |
| B. | 通过品红溶液 | |
| C. | 先通过小苏打溶液,再通过石灰水 | |
| D. | 先通过足量溴水溶液,再通过石灰水 |