题目内容
1.M元素的阳离子与N元素的阴离子具有相同的电子层结构,有关两元素的下列叙述:①原子半径M<N;②离子半径M>N;③原子序数M>N;④原子最外层电子数M<N;⑤M的正价与N的负价绝对值一定相等;⑥元素所在的周期数:M>N;⑦元素的非金属性:M>N.
其中正确的组合是( )
| A. | ①②⑦ | B. | ③④⑤⑥⑦ | C. | ③⑤ | D. | ③④⑥ |
分析 M元素的阳离子与N元素的阴离子具有相同的电子层结构,则M为N下一周期的金属元素,N为M上一周期的非金属元素,如M为Na、Mg、Al等,N为F、O、N等,结合元素周期律来解答.
解答 解:M元素的阳离子与N元素的阴离子具有相同的电子层结构,则M为N下一周期的金属元素,N为M上一周期的非金属元素,则
①电子层越多,原子半径越大,则原子半径M>N,故错误;
②具有相同电子结构的离子中,原子序数大的离子半径小,则离子半径M<N,故错误;
③M在N的下一周期,可知原子序数M>N,故正确;
④M为金属,最外层电子数小于4,N为非金属,最外层电子数≥4,则原子最外层电子数M<N,故正确;
⑤M的正价与N的负价绝对值不一定相等,如M为Na,N为O,故错误;
⑥M在N的下一周期,元素所在的周期数:M>N,故正确;
⑦M为金属、N为非金属性,元素的非金属性:M<N,故错误;
故选D.
点评 本题考查原子结构与元素周期律,为高频考点,把握元素在周期表的位置、元素周期律为解答的关键,侧重分析与应用能力的考查,注意具有电子排布排布时元素的位置,题目难度不大.

练习册系列答案
相关题目
11.下列实验操作或事故处理方法正确的是( )
| A. | 金属Na着火,立即用水扑灭 | |
| B. | 做蒸馏实验时,应使温度计水银球位于蒸馏烧瓶支管口处 | |
| C. | 衣服沾上大量浓氢氧化钠溶液,需将此衣服浸泡在盛水的盆中 | |
| D. | 测试某溶液的pH时,先用水润湿pH试纸,再将待测液滴到pH试纸上 |
12.下列化合物在核磁共振氢谱中能出现两组峰,且其峰面积之比为2:1的有( )
| A. | CH3COOCH3 | B. | CH3COCH3 | C. | C6H5OH | D. | CH2=CH-CH=CH2 |
9.下列有关氢化物的叙述中正确的是( )
| A. | 在卤化氢中HF最稳定 | B. | HCl的电子式为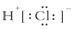 | ||
| C. | 一个D2O分子所含的中子数为8 | D. | 稳定性:H2S>HF |
6.金属铈(58Ce)常用于制作稀土磁性材料,可应用于制造玻璃、打火石、陶瓷和合金等.已知:Ce4++Fe2+═Ce3++Fe3+.下列说法正确的是( )
| A. | Ce元素位于元素周期表第六周期第IIIB族 | |
| B. | ${\;}_{58}^{138}$Ce、${\;}_{58}^{142}$Ce是同素异形体 | |
| C. | 铈能溶于HI溶液,发生反应的离子方程式为:Ce+4H+=Ce4++2H2 | |
| D. | 铈的原子核外有58个电子 |
20.下列各物质中,互为同系物的是( )
| A. | HCOOCH3和 CH3COOH | B. | CHCl3和氯乙烷 | ||
| C. |  和 和 | D. |  和 和 |
 ①已知0.4mol液态肼(N2H4)和足量H2O2反应,生成氮气和水蒸气时放出256.65kJ的热量.写出该反应的热化学方程式:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g);△H=-641.6KJ/mol.
①已知0.4mol液态肼(N2H4)和足量H2O2反应,生成氮气和水蒸气时放出256.65kJ的热量.写出该反应的热化学方程式:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g);△H=-641.6KJ/mol.