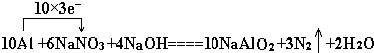题目内容
8.化学与社会、生产、生活密切相关.下列说法正确的是( )| A. | 用激光笔分别照射盛有牛奶、食盐水的玻璃杯,都有光亮的通路 | |
| B. | 神舟10号飞船所用太阳能电池板可将光能转换为电能,转换材料是二氧化硅 | |
| C. | 氯气溶于水生成次氯酸有强氧化性,可以起到除去水中杂质和杀菌消毒作用 | |
| D. | 可以用物理方法或化学方法从海水中提取所需物质 |
分析 A.丁达尔效应是胶体的特性;
B.太阳能电池板的主要成分是硅单质;
C.次氯酸有强氧化性;
D.没有生成其它物质的变化叫做物理变化;生成了其它物质的变化叫做化学变化.
解答 解:A.牛奶是胶体有丁达尔效应,食盐水是溶液,没有,故A错误;
B.太阳能电池板的主要成分是硅单质,不是二氧化硅,故B错误;
C.次氯酸有强氧化性,能杀菌消毒,不能去除杂质,故C错误;
D.海水中含有食盐、水等物质,故获取淡水、食盐的过程中没有新物质生成,属于物理变化;海水中含有不含镁、纯碱等物质,故从海水中获取镁、纯碱等的过程中有新物质生成,属于化学变化,故D正确.
故选D.
点评 本题考查物理变化、胶体、硅的用途和净水原理,题目难度不大,明确氯水不能净水是解题的关键.

练习册系列答案
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案
相关题目
18.能正确表示下列反应的离子方程式是( )
| A. | FeO与稀硝酸反应:FeO+2H+═Fe2++H2O | |
| B. | (NH4)2Fe(SO4)2溶液与过量NaOH溶液反应:Fe2++2OH-═Fe(OH)2↓ | |
| C. | 溴化亚铁溶液中通入足量氯气:2Fe2++4Br-+3Cl2═2Fe3++2 Br2+6Cl- | |
| D. | 向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2+2Fe3+═2Fe(OH)3+3Mg2+ |
16.近年来,由于二氧化碳的大量排放,直接威胁着人类赖于生存的生态环境.人们愈来愈关注着二氧化碳气体的开发及利用.
(1)据报道,美国海军科学家拟从海水中提取H2,从空气中提取CO2合成短链羟来代替汽油.已知氢气的燃烧热为-285.8kJ•mol-1;辛烷(C8H18,可作为汽油用)的燃烧热为-5518kJ•mol-1.写出CO2和H2合成辛烷的热化成方程式8CO2(g)+25H2(g)=C8H18(l)+16H2O(l)△H=-1627 k J•mol-1.
(2)二氧化碳加氢合成甲醇是其合理利用碳资源的有效途径之一,反应如下:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H
①某温度下,将1molCO2和3molH2充入体积不变的2L密闭容器中,发生上述反应,下列能确定该条件下反应达到最大转化限度的是AB.
A、CO2含量不再变化 B、容器内压强不再变化
C、3v正(H2)=v逆(CH3OH) D、△H不再发生变化
②同时测得不同时刻的反应前后压强关系如下:
则用氢气表示前2小时反应平均速率V(H2)=0.225mol/(L•h).
列式计算该温度下CO2的平衡转化率:40%.
③若反应条件为压强6MPa,300℃的反应温度下二氧化碳和氢气按1:3的比例通入,测得二氧化碳的平衡转化率℃为50%,该反应该条件的平衡常数KP=$\frac{1}{27}$(MPa)-2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数);列举提高CO2转化率的措施增大氢气与CO2的比例或及时分离出甲醇或水蒸气.
(3)CO2和NaOH溶液反应可生成NaHCO3溶液,查阅资料得常温下H2CO3的电离平衡常数K1=4.2×10-7,K2=5.6×10-11;实验测得常温下0.1mol/L的NaHCO3的pH为8,则0.1mol/L的NaHCO3溶液中离子浓度大小顺序为A.
A、c(Na+)>c(HCO3-)>c(OH-)>c(CO32-)>c(H+)
B、c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
C、c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-)
D、c(Na+)>c(OH-)>c(HCO3-)>c(H+)>c(CO32-)
(1)据报道,美国海军科学家拟从海水中提取H2,从空气中提取CO2合成短链羟来代替汽油.已知氢气的燃烧热为-285.8kJ•mol-1;辛烷(C8H18,可作为汽油用)的燃烧热为-5518kJ•mol-1.写出CO2和H2合成辛烷的热化成方程式8CO2(g)+25H2(g)=C8H18(l)+16H2O(l)△H=-1627 k J•mol-1.
(2)二氧化碳加氢合成甲醇是其合理利用碳资源的有效途径之一,反应如下:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H
①某温度下,将1molCO2和3molH2充入体积不变的2L密闭容器中,发生上述反应,下列能确定该条件下反应达到最大转化限度的是AB.
A、CO2含量不再变化 B、容器内压强不再变化
C、3v正(H2)=v逆(CH3OH) D、△H不再发生变化
②同时测得不同时刻的反应前后压强关系如下:
| 时间(h) | 1 | 2 | 3 | 4 | 5 | 6 |
| P后/P前 | 0.90 | 0.85 | 0.82 | 0.81 | 0.80 | 0.80 |
列式计算该温度下CO2的平衡转化率:40%.
③若反应条件为压强6MPa,300℃的反应温度下二氧化碳和氢气按1:3的比例通入,测得二氧化碳的平衡转化率℃为50%,该反应该条件的平衡常数KP=$\frac{1}{27}$(MPa)-2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数);列举提高CO2转化率的措施增大氢气与CO2的比例或及时分离出甲醇或水蒸气.
(3)CO2和NaOH溶液反应可生成NaHCO3溶液,查阅资料得常温下H2CO3的电离平衡常数K1=4.2×10-7,K2=5.6×10-11;实验测得常温下0.1mol/L的NaHCO3的pH为8,则0.1mol/L的NaHCO3溶液中离子浓度大小顺序为A.
A、c(Na+)>c(HCO3-)>c(OH-)>c(CO32-)>c(H+)
B、c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
C、c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-)
D、c(Na+)>c(OH-)>c(HCO3-)>c(H+)>c(CO32-)
3.配制一定物质的量浓度的溶液时,下列操作会导致所配溶液浓度偏高的是( )
| A. | 定容时仰视容量瓶的刻度线 | |
| B. | 在用蒸馏水洗涤烧杯时,洗涤液未全部转移到容量瓶中 | |
| C. | 配制盐酸溶液用量筒量取浓盐酸时仰视刻度线 | |
| D. | 用来配制溶液的容量瓶用蒸馏水洗涤后未进行干燥处理 |
20.海水中蕴藏着丰富的资源.海水综合利用的流程图如图.
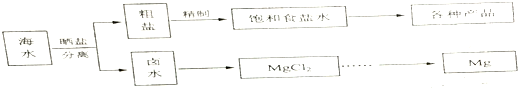
(1)用NaCl做原料可以得到多种产品.
①工业上由NaCl制备金属钠的化学方程式是2NaCl(熔融)$\frac{\underline{\;电解\;}}{\;}$2Na+Cl2↑.
②实验室用惰性电极电解100mL0.1mol/LNaCl溶液,若阴阳两极均得到112mL所体(标准状况),则所得溶液的pH为13(忽略反应前后溶液的体积变化).
③电解氯化钠稀溶液可制备“84消毒液”,通电时氯气被溶液完全吸收,若所得消毒液仅含一种溶质,写出相应的化学方程式:NaCl+H2O$\frac{\underline{\;电解\;}}{\;}$NaClO+H2↑.
(2)分离出粗盐后的卤水中蕴含着丰富的镁资源,经转化后可获得MgCl2粗产品.
①粗产品的溶液中含有Na+、Fe2+、Fe3+和Mn2+,需将Fe2+、Fe3+、Mn2+转化为沉淀除去.Fe(OH)2呈絮状,常将其转化为Fe(OH)3而除去(生成氢氧化物沉淀的pH见表).若只加一种上述(1)中得到的产品,该物质的化学式为NaClO,控制溶液的pH为9.6≤PH<9.8.
②在家用电热水器不锈钢内胆表面镶嵌镁棒,利用电化学原理来防止内胆腐蚀,写出正极的电极反应式:O2+4e-+2H2O═4OH-.

(1)用NaCl做原料可以得到多种产品.
①工业上由NaCl制备金属钠的化学方程式是2NaCl(熔融)$\frac{\underline{\;电解\;}}{\;}$2Na+Cl2↑.
②实验室用惰性电极电解100mL0.1mol/LNaCl溶液,若阴阳两极均得到112mL所体(标准状况),则所得溶液的pH为13(忽略反应前后溶液的体积变化).
③电解氯化钠稀溶液可制备“84消毒液”,通电时氯气被溶液完全吸收,若所得消毒液仅含一种溶质,写出相应的化学方程式:NaCl+H2O$\frac{\underline{\;电解\;}}{\;}$NaClO+H2↑.
(2)分离出粗盐后的卤水中蕴含着丰富的镁资源,经转化后可获得MgCl2粗产品.
①粗产品的溶液中含有Na+、Fe2+、Fe3+和Mn2+,需将Fe2+、Fe3+、Mn2+转化为沉淀除去.Fe(OH)2呈絮状,常将其转化为Fe(OH)3而除去(生成氢氧化物沉淀的pH见表).若只加一种上述(1)中得到的产品,该物质的化学式为NaClO,控制溶液的pH为9.6≤PH<9.8.
②在家用电热水器不锈钢内胆表面镶嵌镁棒,利用电化学原理来防止内胆腐蚀,写出正极的电极反应式:O2+4e-+2H2O═4OH-.
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Mn(OH)2 | 8.3 | 9.6 |
| Mg(OH)2 | 9.8 | 11.1 |
15.为充分利用海洋资源,美国斯坦福大学研究人员发明了“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为5MnO2+2Ag+2NaCl═Na2Mn5O10+2AgCl.下列有关“水”电池在海水中放电时的说法正确的是( )
| A. | 负极反应式:Ag+Cl-+e-═AgCl | |
| B. | Na+不断向“水”电池的正极移动 | |
| C. | 每生成1molNa2Mn5O10转移2mol电子 | |
| D. | AgCl是还原产物 |
 某温度下的溶液中,c (H+)=10x mol/L,c (OH-)=10y mol/L.
某温度下的溶液中,c (H+)=10x mol/L,c (OH-)=10y mol/L.