题目内容
1.下列反应中,属于水解反应且使溶液显酸性的是( )| A. | CH3COOH+OH-?CH3COO-+H2O | B. | HCO3-+H2O?CO32-+H3O+ | ||
| C. | S2-+H2O?HS-+OH- | D. | NH4++H2O?NH3•H2O+H+ |
分析 水解反应的概念:在溶液中盐电离出的离子与水电离出的氢离子和氢氧根结合生成弱电解质的反应.
A、醋酸可以和碱反应生成盐和水;
B、属于碳酸氢根的电离方程式;
C、离子的水解反应是可逆的过程,硫离子是多元弱酸阴离子分步水解,溶液显碱性;
D、氨根离子水解生成一水合氨以及氢离子.
解答 解:在溶液中盐电离出的离子与水电离出的氢离子和氢氧根结合生成弱电解质的反应是水解反应,
A、醋酸可以和碱反应生成盐和水,该反应是醋酸和强碱之间的反应方程式,故A错误;
B、该式子是碳酸氢根的电离方程式,故B错误;
C、硫离子的水解反应是可逆、分步进行的过程,溶液显碱性,故C错误;
D、氨根离子水解生成一水合氨以及氢离子,溶液显示酸性,故D正确.
故选D.
点评 本题考查水解原理,水解反应的概念是在溶液中盐电离出的离子与水电离出的氢离子和氢氧根结合生成弱电解质的反应,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
11.食醋(主要成分CH3COOH )、纯碱(Na2CO3 )和小苏打(NaHCO3 )均为家庭厨房中常用的物质.已知:
请回答下列问题:
(1)一定温度下,向0.1mol/LCH3COOH 溶液中加入少量CH3COONa 晶体时,下列说法正确的是ad(填代号).
a.溶液的pH增大 b. CH3COOH的电离程度增大
c.溶液的导电能力减弱 d.溶液中c(OH-)•c(H+)不变
(2)25℃时,向CH3COOH溶液中加入一定量的NaHCO3,所得混合液的pH=6,则混合液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$=18.
(3)常温下,将20mL 0.1mol•L-1 CH3COOH溶液和20mL0.1mol•L-1HNO2溶液分别与20mL 0.1 mol•L-1NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图1所示,则表示CH3COOH溶液的曲线是②(填写序号);反应结束后所得两溶液中,c(CH3COO-)<c(NO2-)(填“>”、“<”或“=”);
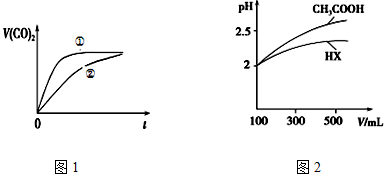
(4)体积均为100mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如上图2所示,则HX的电离平衡常数小于(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数.
(5)25℃时,将等体积、等物质的量浓度的醋酸与氨水混合后,溶液的pH=7,则NH3•H2O的电离常数Kb=1.8×10-5.
| 弱酸 | CH3COOH | H | HNO |
| 电离常数(25℃) | K=1.8×10-5 | K=4.×10-7 K=5.6×10-11 | K=5.0×10-4 |
(1)一定温度下,向0.1mol/LCH3COOH 溶液中加入少量CH3COONa 晶体时,下列说法正确的是ad(填代号).
a.溶液的pH增大 b. CH3COOH的电离程度增大
c.溶液的导电能力减弱 d.溶液中c(OH-)•c(H+)不变
(2)25℃时,向CH3COOH溶液中加入一定量的NaHCO3,所得混合液的pH=6,则混合液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$=18.
(3)常温下,将20mL 0.1mol•L-1 CH3COOH溶液和20mL0.1mol•L-1HNO2溶液分别与20mL 0.1 mol•L-1NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图1所示,则表示CH3COOH溶液的曲线是②(填写序号);反应结束后所得两溶液中,c(CH3COO-)<c(NO2-)(填“>”、“<”或“=”);

(4)体积均为100mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如上图2所示,则HX的电离平衡常数小于(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数.
(5)25℃时,将等体积、等物质的量浓度的醋酸与氨水混合后,溶液的pH=7,则NH3•H2O的电离常数Kb=1.8×10-5.
12.下列说法正确的是( )
| A. | 氯水氨水食盐水都能导电,所以Cl2、NH3和氯化钠都是电解质 | |
| B. | 向醋酸溶液中加入少量醋酸溶液,原醋酸电离平衡一定向正向移动 | |
| C. | 升高温度能促进弱电解质的电离 | |
| D. | 强电解质溶液的导电能力一定比弱电解质溶液的导电能力强 |
9.某温度下,0.1mol/L醋酸溶液的pH=3.将该温度下0.2mol/L醋酸溶液和0.2mol/L醋酸钠溶液等体积混合后,混合液的pH=4.7.下列说法正确的是( )
| A. | 该温度下,0.0l mol/L醋酸溶液的pH=4 | |
| B. | 该温度下,用0.1 mol/L醋酸和0.01 mol/L醋酸分别完全中和等体积0.1 mol/L的NaOH溶液,消耗两醋酸的体积比为1:10 | |
| C. | 该温度下,0.2 mol/L醋酸溶液和0.4 mol/L醋酸钠溶液等体积混合后,混合液的pH<4.7 | |
| D. | 该温度下,0.2 mol/L盐酸溶液和0.4 mol/L醋酸钠溶液等体积混合后,混合液的pH>4.7 |
6.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 常温常压下,14 g丙烯和丁烯的混合气体含有的原子数为6NA | |
| B. | 25℃,pH=1的1 L H2SO4溶液含有的H+数目为0.2NA | |
| C. | 1 mol Fe与一定量的HNO3反应,转移的电子数目一定为3NA | |
| D. | 标准状况下,22.4 L NO和O2的混合气体中所含原子数为2NA |
10.下列说法正确的是( )
| A. | 乙醇和乙酸能发生酯化反应,只要一种反应物过量酯化反应就能进行彻底 | |
| B. | 把乙烯通入溴水中,溴水立即褪色,这是由于乙烯具有漂白性 | |
| C. | 煤的气化和煤的干馏都发生了化学变化,而石油的分馏属于物理变化 | |
| D. | 苯不能使酸性KMnO4溶液褪色,因此苯不能发生氧化反应 |
11.现有部分短周期元素的性质、应用或原子结构如下表:
(1)元素X可测定文物年代的同位素符号是614C.
(2)元素Y与氢元素形成一种离子YH4+,实验室液检溶液中含有这种离子方法是:NH4++OH-=NH3↑+H2O(仅用离子反应方程式表示).
(3)元素Z与元素T相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是bd.
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
d.Z的最高价氧化物对应水化物的酸性比T的最高价氧化物对应水化物的酸性强
(4)探寻物质性质的差异性是学习的重要方法之一.T、X、Y、Z四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种的酸是H2CO3,理由是H2CO3是弱酸,其他三种酸是强酸.
| 元素编号 | 元素性质或原子结构 |
| T | M层电子数是K层电子数的3倍 |
| X | 一种同位素可测定文物年代 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
(2)元素Y与氢元素形成一种离子YH4+,实验室液检溶液中含有这种离子方法是:NH4++OH-=NH3↑+H2O(仅用离子反应方程式表示).
(3)元素Z与元素T相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是bd.
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
d.Z的最高价氧化物对应水化物的酸性比T的最高价氧化物对应水化物的酸性强
(4)探寻物质性质的差异性是学习的重要方法之一.T、X、Y、Z四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种的酸是H2CO3,理由是H2CO3是弱酸,其他三种酸是强酸.


 .
. .
.