题目内容
(二)工业上采用乙苯与CO2脱氢生产重要化工原料苯乙烯
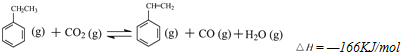
(1)在3L密闭容器内,乙苯与CO2的反应在三种不同的条件下进行实验,乙苯、CO2的起始浓度分别为1.0mol/L和3.0mol/L,其中实验Ⅰ在T1℃,0.3MPa,而实验Ⅱ、Ⅲ分别改变了实验其他条件;乙苯的浓度随时间的变化如图Ⅰ所示.
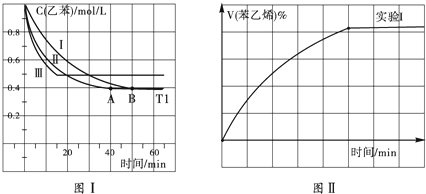
①实验I乙苯在0-50min时的反应速率为
②实验Ⅱ可能改变条件的是
③图Ⅱ是实验Ⅰ中苯乙烯体积分数V%随时间t的变化曲线,请在图Ⅱ中补画实验Ⅲ中苯乙烯体积分数V%随时间t的变化曲线.
(2)若实验Ⅰ中将乙苯的起始浓度改为1.2mol/L,其他条件不变,乙苯的转化率将 (填“增大”、“减小”或“不变”),计算此时平衡常数为 .
(1)在3L密闭容器内,乙苯与CO2的反应在三种不同的条件下进行实验,乙苯、CO2的起始浓度分别为1.0mol/L和3.0mol/L,其中实验Ⅰ在T1℃,0.3MPa,而实验Ⅱ、Ⅲ分别改变了实验其他条件;乙苯的浓度随时间的变化如图Ⅰ所示.

①实验I乙苯在0-50min时的反应速率为
②实验Ⅱ可能改变条件的是
③图Ⅱ是实验Ⅰ中苯乙烯体积分数V%随时间t的变化曲线,请在图Ⅱ中补画实验Ⅲ中苯乙烯体积分数V%随时间t的变化曲线.
(2)若实验Ⅰ中将乙苯的起始浓度改为1.2mol/L,其他条件不变,乙苯的转化率将
考点:物质的量或浓度随时间的变化曲线,化学平衡的计算
专题:化学平衡专题
分析:(1)①根据图I中乙苯的浓度变化及v=
计算出实验I乙苯在0-50min时的反应速率;
②根据图象中图I中实验Ⅱ改变条件平衡不移动,而反应速率增大进行判断改变的条件;
③实验Ⅲ中改变条件,由图I可知乙苯的浓度增大,平衡逆移,所以苯乙烯体积分数V%随时间t增大而减小;
(2)根据加入乙苯引起的浓度增大量与平衡移动引起的浓度减小量的相对关系分析;若实验I中将乙苯的起始浓度改为1.2mol/L,其他条件不变,因为温度不变,则K不变,根据图I中数据求出K的值.
| △c |
| △t |
②根据图象中图I中实验Ⅱ改变条件平衡不移动,而反应速率增大进行判断改变的条件;
③实验Ⅲ中改变条件,由图I可知乙苯的浓度增大,平衡逆移,所以苯乙烯体积分数V%随时间t增大而减小;
(2)根据加入乙苯引起的浓度增大量与平衡移动引起的浓度减小量的相对关系分析;若实验I中将乙苯的起始浓度改为1.2mol/L,其他条件不变,因为温度不变,则K不变,根据图I中数据求出K的值.
解答:
解(1)①根据图I中可知,0-50min时乙苯的浓度变化为:1.0mol/L-0.4mol/L=0.6mol/L,则其反应速率为:v=
=0.012mol/(L?min),
故答案为:0.012mol/(L?min);
②根据图I中实验Ⅱ改变条件平衡不发生移动,而反应速率增大,所以改变的条件为:加催化剂,故答案为:加催化剂;
③实验Ⅲ中改变条件,由图I可知乙苯的浓度增大,平衡向着逆向移动,所以苯乙烯体积分数V%随时间t增大而减小,则实验Ⅲ中苯乙烯体积分数V%随时间t的变化曲线为 ,
,
故答案为: ;
;
(2)若实验I中将乙苯的起始浓度改为1.2mol/L,其他条件不变,平衡正移,由于二氧化碳的初始浓度没变,平衡移动引起的乙苯的浓度的减小量小于加入的乙苯引起的浓度增加量,所以乙苯的转化率减小;
根据图I中实验1可知,0-50min时乙苯的浓度变化为1.0mol/L-0.4mol/L=0.6mol/L
C6H5CH2CH3+CO2?C6H5CH=CH2 +CO+H2O
起始浓度(mol/L):1.0 3.0 0 0 0
反应浓度(mol/L):0.6 0.6 0.6 0.6 0.6
平衡浓度(mol/L):0.4 2.4 0.6 0.6 0.6
则K=
=0.225,
故答案为:减小;0.225.
| 0.6mol/L |
| 50min |
故答案为:0.012mol/(L?min);
②根据图I中实验Ⅱ改变条件平衡不发生移动,而反应速率增大,所以改变的条件为:加催化剂,故答案为:加催化剂;
③实验Ⅲ中改变条件,由图I可知乙苯的浓度增大,平衡向着逆向移动,所以苯乙烯体积分数V%随时间t增大而减小,则实验Ⅲ中苯乙烯体积分数V%随时间t的变化曲线为
 ,
,故答案为:
 ;
;(2)若实验I中将乙苯的起始浓度改为1.2mol/L,其他条件不变,平衡正移,由于二氧化碳的初始浓度没变,平衡移动引起的乙苯的浓度的减小量小于加入的乙苯引起的浓度增加量,所以乙苯的转化率减小;
根据图I中实验1可知,0-50min时乙苯的浓度变化为1.0mol/L-0.4mol/L=0.6mol/L
C6H5CH2CH3+CO2?C6H5CH=CH2 +CO+H2O
起始浓度(mol/L):1.0 3.0 0 0 0
反应浓度(mol/L):0.6 0.6 0.6 0.6 0.6
平衡浓度(mol/L):0.4 2.4 0.6 0.6 0.6
则K=
| 0.6×0.6×0.6 |
| 0.4×2.4 |
故答案为:减小;0.225.
点评:本题考查了化学平衡影响因素、化学平衡常数的计算等知识,题目难度中等,注意掌握化学平衡及其影响因素,明确化学平衡常数、化学反应速率的概念及计算方法;(2)中平衡常数的计算依据图I中的实验1分析计算.

练习册系列答案
相关题目