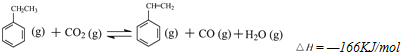题目内容
某石油液化气由丙烷和丁烷组成,其质量分数分别为80%和20%.C3H8(g)+5O2(g)═3CO2(g)+4H2O(g)△H(298K)=-2 200kJ?mol-1,2C4H10(g)+13O2(g)═8CO2(g)+10H2O(g)△H(298K)=-5 800kJ?mol-1.现有一质量为0.80kg、容积为4.0L的铝壶,将一壶20℃的水烧开需消耗0.056kg石油液化气,试计算该燃烧的利用率.已知水的比热容为4.2kJ?(kg?℃)-1,铝的比热容为0.88kJ?(kg?℃)-1.
考点:有关反应热的计算
专题:化学反应中的能量变化
分析:将一壶20℃的水烧开,需将铝壶本身从0℃升高到80℃,需将壶中的水从0℃升高到80℃,所以烧水需要的能量是这两项之和,0.056kg石油液化气由丙烷和丁烷组成,其质量分数分别为80%和20%,质量分别是56g×80%=44.8g、56g×20&=11.2g,依据C3H8(g)+5O2(g)═3CO2(g)+4H2O(g)△H(298K)=-2 200kJ?mol-1,2C4H10(g)+13O2(g)═8CO2(g)+10H2O(g)△H(298K)=-5 800kJ?mol-1,分别求出燃烧放出的热量,燃料的利用率为烧水需要的能量除以燃烧燃烧放出的总能量,据此分析解答.
解答:
解:将一壶20℃的水烧开,需将铝壶本身从0℃升高到80℃,需将壶中的水从0℃升高到80℃,所以烧水需要的能量为Q=c1m1(t-t0)+c2m2(t-t0)=0.88×103J/(kg?℃)×0.8kg×(80℃-0℃)+4.2×103J/(kg?℃)×4kg×(80℃-0℃)=1400.32kJ,
0.056Kg中丙烷和丁烷的质量分别为:0.056kg×80%=44.8g、0.056kg×20%=11.2g
物质的量分别是n=
=
=1.0mol、n=
=
=0.2mol
根据C3H8(g)+5O2(g)═3CO2(g)+4H2O(g)△H(298K)=-2 200kJ?mol-1,2C4H10(g)+13O2(g)═8CO2(g)+10H2O(g)△H(298K)=-5 800kJ?mol-1,完全燃烧放出的热量是1.0mol×2220kJ/mol+0.1mol×5800kJ/mol=2800.0kJ
因此该燃料的利用率是
×100%≈50%,
答:燃烧的利用率50%.
0.056Kg中丙烷和丁烷的质量分别为:0.056kg×80%=44.8g、0.056kg×20%=11.2g
物质的量分别是n=
| m |
| M |
| 44.8g |
| 44g/mol |
| m |
| M |
| 11.2g |
| 56g/mol |
根据C3H8(g)+5O2(g)═3CO2(g)+4H2O(g)△H(298K)=-2 200kJ?mol-1,2C4H10(g)+13O2(g)═8CO2(g)+10H2O(g)△H(298K)=-5 800kJ?mol-1,完全燃烧放出的热量是1.0mol×2220kJ/mol+0.1mol×5800kJ/mol=2800.0kJ
因此该燃料的利用率是
| 1400.32 |
| 2800 |
答:燃烧的利用率50%.
点评:本题考查热量的计算,关键是公式及其变形的灵活运用,解题过程中要注意单位的换算,题目难度中等.

练习册系列答案
相关题目
关于元素周期律和元素周期表叙述正确的是( )
| A、元素的原子序数依次递增,元素相对原子质量也依次递增 |
| B、主族元素原子的最外层电子数等于它的最高正价数 |
| C、主族元素原子的电子层数等于其所处的周期数 |
| D、随核电荷数的递增,离子半径也依次递减 |
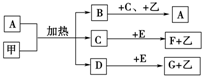 已知化合物A、B、C、D、E、F、G和单质甲、乙所含元素均为短周期元素,A的浓溶液与甲能发生如图所示的反应,甲是常见的固体单质,乙是常见的气体单质,B是无色气体,是主要的大气污染物之一,请根据图示回答问题.
已知化合物A、B、C、D、E、F、G和单质甲、乙所含元素均为短周期元素,A的浓溶液与甲能发生如图所示的反应,甲是常见的固体单质,乙是常见的气体单质,B是无色气体,是主要的大气污染物之一,请根据图示回答问题.