题目内容
据报道,最近摩托罗拉公司研制出了一种由甲醇和氧气以及强碱作电解质溶液的新型手机电池,电量可达现用镍氢电池或锂电池的10倍,可连续使用一个月才充一次电.
请回答以下问题:
(1)甲醇是 极,电极反应是 .
(2)电池反应的离子方程式是 .
请回答以下问题:
(1)甲醇是
(2)电池反应的离子方程式是
考点:原电池和电解池的工作原理
专题:电化学专题
分析:甲醇燃料电池放电时,C元素的化合价升高,所以甲醇所在电极为原电池的负极,O元素的化合价降低,所以通入氧气的极为原电池的正极,负极上发生氧化反应,正极上发生还原反应,以此来解答.
解答:
解:CH3OH和O2在电池中,肯定是O2氧化CH3OH,CH3OH是负极反应物,O2是正极反应物.CH3OH被氧化生成CO2和H2O,电解质溶液中有强碱(OH-),CO2要转化CO32-.
(1)甲醇是负极,电极反应式为:CH3OH+8OH--6e-═CO32-+6H2O,故答案为:负;CH3OH+8OH--6e-═CO32-+6H2O;
(2)CH3OH被氧化生成CO2和H2O,电解质溶液中有强碱(OH-),则CO2要转化CO32-,电池反应为:2CH3OH+3O2+4OH-═2CO32-+6H2O,故答案为:2CH3OH+3O2+4OH-═2CO32-+6H2O.
(1)甲醇是负极,电极反应式为:CH3OH+8OH--6e-═CO32-+6H2O,故答案为:负;CH3OH+8OH--6e-═CO32-+6H2O;
(2)CH3OH被氧化生成CO2和H2O,电解质溶液中有强碱(OH-),则CO2要转化CO32-,电池反应为:2CH3OH+3O2+4OH-═2CO32-+6H2O,故答案为:2CH3OH+3O2+4OH-═2CO32-+6H2O.
点评:本题考查了原电池原理,明确放电时各个电极上发生的电极反应是解本题关键,难点是电极反应式的书写,要注意结合电解质溶液酸碱性书写,为易错点.

练习册系列答案
相关题目
下列叙述正确的是( )
| A、同周期元素中,ⅦA族元素的原子半径最大 |
| B、ⅥA族元素的原子,其半径越大,越容易得到电子 |
| C、室温时,零族元素的单质都是气体 |
| D、所有主族元素的原子,形成单原子离子时的化合价和它的族序数相等 |
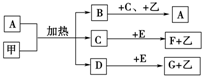 已知化合物A、B、C、D、E、F、G和单质甲、乙所含元素均为短周期元素,A的浓溶液与甲能发生如图所示的反应,甲是常见的固体单质,乙是常见的气体单质,B是无色气体,是主要的大气污染物之一,请根据图示回答问题.
已知化合物A、B、C、D、E、F、G和单质甲、乙所含元素均为短周期元素,A的浓溶液与甲能发生如图所示的反应,甲是常见的固体单质,乙是常见的气体单质,B是无色气体,是主要的大气污染物之一,请根据图示回答问题.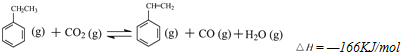

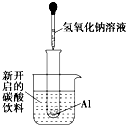 如图所示,把试管小心地放入盛有(20℃)碳酸饮料的烧杯中,试管中开始放入几小块铝片,再用滴管滴加5mL浓NaOH溶液于试管中,试回答下列问题:
如图所示,把试管小心地放入盛有(20℃)碳酸饮料的烧杯中,试管中开始放入几小块铝片,再用滴管滴加5mL浓NaOH溶液于试管中,试回答下列问题: